دوره 26، شماره 4 - ( پائیز 1399 )
جلد 26 شماره 4 صفحات 447-432 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Pourlak T, Halimi M, Pourlak T, Maroufi P, Ghaderpour S, Shokoohi A. Effect of Extracts of Cloves (Syzygium Aromaticum) on Hepatic Cell Damage and Oxidative Stress Caused by Diabetes in Adult Rats. Intern Med Today 2020; 26 (4) :432-447
URL: http://imtj.gmu.ac.ir/article-1-3534-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3534-fa.html
پورلک طلا، حلیمی منیره، پورلک طناز، معروفی پرهام، قادرپور صابر، شکوهی عارفه. اثر عصاره میخک بر آسیب سلول های کبدی و استرس اکسیداتیو ناشی از دیابت در موش های صحرایی بالغ. طب داخلی روز. 1399; 26 (4) :432-447
طلا پورلک1 

 ، منیره حلیمی1
، منیره حلیمی1 

 ، طناز پورلک2
، طناز پورلک2 
 ، پرهام معروفی*3
، پرهام معروفی*3 

 ، صابر قادرپور4
، صابر قادرپور4 

 ، عارفه شکوهی5
، عارفه شکوهی5 




 ، منیره حلیمی1
، منیره حلیمی1 

 ، طناز پورلک2
، طناز پورلک2 
 ، پرهام معروفی*3
، پرهام معروفی*3 

 ، صابر قادرپور4
، صابر قادرپور4 

 ، عارفه شکوهی5
، عارفه شکوهی5 


1- گروه پاتولوژی، دانشکده پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران.
2- گروه جراحی دهان و فک، مرکز تحقیقات پیری، دانشکده دندان پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران.
3- گروه ارتوپدی، دانشکده پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران. ،drparhammarofi@gmail.com
4- کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران.
5- کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علو مپزشکی خراسان شمالی، بجنورد، ایران.
2- گروه جراحی دهان و فک، مرکز تحقیقات پیری، دانشکده دندان پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران.
3- گروه ارتوپدی، دانشکده پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران. ،
4- کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علو مپزشکی تبریز، تبریز، ایران.
5- کمیته تحقیقات دانشجویی، دانشکده پزشکی، دانشگاه علو مپزشکی خراسان شمالی، بجنورد، ایران.
متن کامل [PDF 4998 kb]
(2325 دریافت)
| چکیده (HTML) (4799 مشاهده)
سطح سرمی انسولین
در همه گروههای DC، DG و DSA در مقایسه با گروه کنترل، میزان انسولین سرم به طور معنیداری کاهش یافته است (0/05>P) و همچنین در گروههای DG و DSA نسبت به گروه DC میزان انسولین افزایش یافته است. این افزایش در گروه DSA معنیدار بود (0/05>P) (تصویر شماره 2).
سطح سرمی پروفایل چربی
سطح سرمی کلسترول
سطح کلسترول سرم در گروه DC به طور معنیداری بالاتر از گروه کنترل بود (0/05>P). همچنین میزان کلسترول در گروههای DG و DSA در مقایسه با گروه DC به طور معنیداری کاهش یافت (0/05>P) (جدول شماره 1).
.jpg)
سطح سرمی لیپوپروتئین کمچگالی (LDL)
در گروه DC نسبت به گروه کنترل سطح سرمی LDL به میزان کمی افزایش یافته است (0/05>P) همچنین، سطح LDL در گروههای DG و DSA در مقایسه با گروه DC به طور معنیداری کاهش یافته است (0/05>P) (جدول شماره 1).
سطح سرمی لیپوپروتئین با چگالی بالا (HDL)
سطح سرمی HDL در گروه DC نسبت به گروه کنترل به طور معنیداری کاهش یافته است (0/05>P). همچنین در گروههای DG و DSA نسبت به گروه DC به طور معنیداری افزایش یافت (0/05>P). از طرف دیگر، سطح HDL در گروه DSA به طور قابل توجهی بالاتر از گروه کنترل بود (0/05>P) (جدول شماره 1).
سطح سرمی تریگلیسیرید (TG)
سطح سرمی TG در گروه DC نسبت به گروه کنترل به طور معنیداری افزایش یافته است (0/05>P). علاوه بر این، سطح TG در گروه DSA در مقایسه با گروه DC به طور قابل توجهی کاهش یافته است (0/05>P). (جدول شماره 1).
مارکرهای استرس اکسیداتیو
در جدول شماره 2 سطح سرمی GPx ،SOD و MDA نشان داده شده است.
.jpg)
فعالیت آنزیم GPx و SOD در گروه کنترل دیابتی به طور قابل توجهی پایینتر از گروه سالم بود (0/05>P). اما، درمان با عصاره میخک فعالیت سرمی GPx و SOD را در مقایسه با گروه دیابت کنترل افزایش داد (0/05>P). در گروه کنترل دیابتی سطح سرمی MDA نسبت به گروه سالم به طور معنیداری افزایش یافت (0/05>P). از طرفی در گروههای تحت درمان با عصاره میخک صدپر نسبت به گروه دیابت کنترل به طور معنیداری کاهش یافت (0/05>P) (جدول شماره 2).
آسیبشناسی بافتی کبد
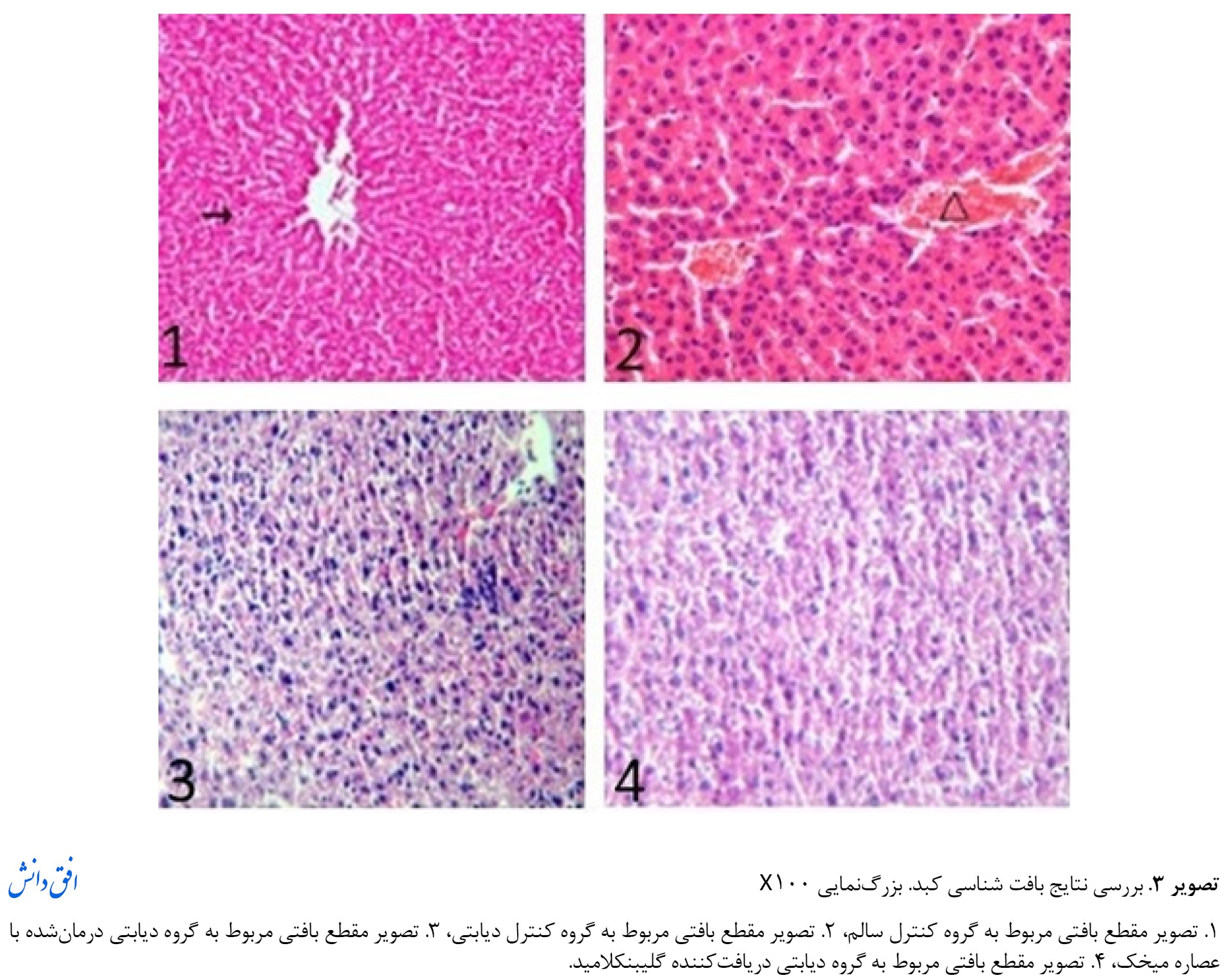
بافت کبد بهدستآمده از گروه سالم، از نظر هیستولوژیک طبیعی بود. مطالعات بافتشناسی نشان داد که دیابت منجر به تغییرات دژنراتیو مانند ادم، پارگی، خونریزی در رگهای مرکزی، گشاد شدن در سینوسوئیدها و هستههای پیکنوتیک میشود. اما، تغییرات دژنراتیو ذکر شده در گروههای درمانی کاهش یافته است (تصویر شماره 3).
بحث
استرپتوزوتوسین ترکیبی است که معمولاً برای القای دیابت نوع 1 در موشهای صحرایی استفاده میشود [16]. استرپتوزوتوسین با کاهش سریع سلولهای بتای لوزالمعده باعث ایجاد دیابت شده، که درنهایت منجر به کاهش ترشح انسولین میشود. بهخوبی مشخص شده است که گلیبنکلامید با افزایش ترشح انسولین از سلولهای بتای موجود در لوزالمعده، باعث ایجاد هیپوگلیسمی میشود. این ترکیب در دیابت متوسط ناشی از STZ (تعدادی از سلولهای بتا هنوز سالم اند) فعال است، در حالی که در دیابت شدید STZ (که تقریباً در تمام سلولهای بتا از بین رفتهاند) غیرفعال میشود [17]. نتایج ما نشان داد که گلیبنکلامید سطح قند خون ناشتا (FBS) را در حیوانات هیپرگلیسمیک کاهش میدهد، بنابراین وضعیت دیابت در حیوانات مورد استفاده متوسط بود. اثرات هیپوگلیسمی عصارههای گیاهی به میزان تخریب سلولهای بتای لوزالمعده بستگی دارد. درمان موشهای صحرایی دیابتی متوسط با عصاره گیاه دارویی، منجر به فعال شدن سلولهای بتا و افزایش تولید انسولین شد [18]. فعالیت آنتیهیپرگلیسمیک عصاره میخک صدپر، با افزایش انسولین پلاسما همراه بود که نشان میدهد فعالیت آنتیهیپرگلیسمیک عصاره میخک صدپر میتواند به دلیل فعالیت انسولینزای این عصاره باشد. افزایش سطح انسولین مشاهدهشده در مطالعه حاضر نشان داد که عصاره میخک صدپر میتواند منجر به ترشح انسولین از بقایای سلولهای بتا و یا سلولهای بتای بازسازیشده شود. همچنین، نتایج این مطالعه نشان داد عصاره میخک صدپر در اثر افزایش ترشح انسولین، میزان قند خون ناشتا را به طور معنیداری کاهش میدهد [19].
دیابت در تعداد زیادی از مسیرهای متابولیکی از جمله متابولیسم لیپیدها تأثیر میگذارد. کمبود انسولین (دیابت نوع 1) یا کاهش عملکرد انسولین (دیابت نوع 2) منجر به کاهش مصرف گلوکز توسط بافت هایی که به انسولین نیاز دارند (مانند کبد) و همچنین افزایش تولید گلوکز از طریق افزایش میزان گلوکونوژنز شده که درنهایت منجر به افت قند خون میشود. در اثر افزایش گلوکز و کاهش سطح انسولین در پلاسمای خون، تنظیم کبدی متابولیسم لیپید بسیار تغییر میکند. از آنجا که انسولین تنظیمکننده مهمی در بسیاری از آنزیمهای درگیر در لیپولیز و لیپوژنز است، کمبود آن باعث ایجاد تغییرات عمدهای در فعالیت این آنزیمها میشود و درنتیجه بر متابولیسم کلی چربیها و پروفایل چربی در بافتهای مختلف تأثیر میگذارد [20].
در دیابت ناشی از STZ، افزایش سطح قند خون معمولاً با افزایش کلسترول پلاسما، تریگلیسیرید و لیپوپروتئین با چگالی کم (LDL) همراه است و لیپوپروتئین با چگالی زیاد (HDL) کاهش مییابد [21]. فعالسازی لیپاز حساس به هورمون در هنگام کمبود انسولین با آزادسازی اسیدهای چرب آزاد (FFAs) از بافت چربی همراه است [22]. بنابراین، اسیدهای چرب اضافی تولیدشده توسط دیابت ناشی از STZ در پلاسما، تبدیل اسیدهای چرب اضافی به فسفولیپیدها و کلسترول را در کبد تقویت میکند. این دو ماده به همراه تریگلیسیریدهای اضافی که در کبد تشکیل شده است، ممکن است به شکل لیپوپروتئین به درون خون تخلیه شوند [16].
مشاهدات ما نشان داد که عصاره میخک بهتنهایی و همراه با گلیبنکلامید باعث کاهش معنیدار کلسترول پلاسما، تریگلیسیرید و لیپوپروتئین با چگالی کم در گروههای دیگر نسبت به گروه کنترل دیابتی شد. همچنین، عصاره میخک صدپر باعث افزایش لیپوپروتئین با چگالی زیاد نسبت به گروه کنترل دیابتی شد (جدول شماره 1). عصاره میخک صدپر احتمالاً از طریق کنترل متابولیسم لیپید، وضعیت لیپید پلاسما را به سطح نرمال برگرداند. این نتایج، در توافق با نتایج مطالعههای گذشته بود [23، 24].
مشاهدات ما نشان داد میخک صدپر باعث افزایش معنیدار GPx، و SOD در گروههای دیگر نسبت به گروه کنترل شد (جدول شماره 2). یکی از روبندههای سیتوپلاسمی رادیکالها که میتواند رادیکالهای آزاد را کاهش دهد گلوتاتیون (GSH) است [25]. به طور کلی اعتقاد بر این است که اثر محافظتی GSH در برابر تجزیه اکسیداتیو لیپیدها، از طریق GPx با کاهش هیدروپراکسیدهای تشکیلشده درونزای اسیدهای چرب اشباع نشده (PUFA) و تبدیل به مشتقات هیدروکسیل انجام میشود [26]. گلوتاتیون (GSH) میتواند با تشکیل کاتالیزورهای فلزدار به طور موقت، شکستن واکنشهای زنجیرهای، کاهش غلظت گونههای واکنشدهنده اکسیژن (ROS) و افزایش سطح آنزیمهای دخیل در سیستم آنتیاکسیدانی (SOD ،CAT ،GPx و GST) مانع از تولید رادیکال آزاد شود [27، 28]. سلنیوم یک کوفاکتور مهم برای آنزیم SOD است [29] و استفاده از عصاره عصاره میخک صدپر در موشهای صحرایی باعث افزایش سلنیوم، کاهش استرس اکسیداتیو و آسیب کبدی میشود. نتایج مشابه در مطالعه آدفگا و همکاران مشاهده شد [8] که نشان میداد واکنش فنتون ترکیبی از H2O2 و Fe2+ است که به طور مکرر برای القای واکنشهای لیپوکسیژناز (LPO) استفاده میشود [30]. LPO هیدروژن را که قدرتمندترین اکسیدان در سیستم بیولوژیکی است از PUFA و رادیکال هیدروکسیل آزاد میکند و میتواند از هیدروژن جداسازی شده از PUFA استفاده کرده و باعث افزایش استرس اکسیداتیو شود [29].
فعالیت آنتیاکسیدانی میخک صدپر ممکن است به دلیل ترکیبات فنولیک مانند اوژنول، اوژنول استات و تیمول باشد [31]. میخک صدپر میتواند از طریق پاک کردن رادیکالهای آزاد، شلات کردن یونهای موقت فلز، مهار آنزیمهای اکسیدان و یا از طریق ترمیم α-توکوفرول و رادیکال α-توکوفوکسسیل، از آسیب دیدن سلولها جلوگیری کند [32]. همچنین، فلاونوئیدها میتوانند رادیکالهای O2 ،OH و پراکسیل را از بین ببرند و از فعالیت LPO جلوگیری کنند [33]. میخک صدپر میتواند SOD ،GPx ،GSH را افزایش داده و MDA را کاهش دهد [34]. هایپرگلیسمی و هایپرلیپیدمی در بیماران دیابتی با افزایش استرس اکسیداتیو همراه است [35] و افزایش سطح MDA در موشهای صحرایی دیابتی نوع 2 نشان میدهد که پراکسیداسیون لیپید افزایشیافته منجر به آسیب بافتی و عدم توانایی مکانیسمهای دفاعی آنتیاکسیدانی برای جلوگیری از حمله رادیکال آزاد میشود که ممکن است منجر به نشت آنزیمها و متابولیتها به گردش خون شود [36].
افزایش سطح آنزیمهایی مانند ALT و AST، نشانگر آسیبهای کبدی است و ارزیابی AST و ALT، به ترتیب شاخصی از وضعیت کبدی و سلولهای نکروتیک را نشان میدهد [37]. همچنین سطح غیرطبیعی آلکالین فسفاتاز در خون میتواند نشاندهنده مشکلاتی مربوط به کبد و یا استخوانها باشد [38]. در مطالعه حاضر، افزایش سطح AST، ALT و ALP در گروه دیابتی نسبت به گروه کنترل به طور معنیداری بالا بود. همچنین در گروه درمانی با میخک صدپر کاهش معنیداری در سطح AST و ALT نسبت به گروه دیابتی مشاهده شد. در مطالعات گذشته، افزایش میزان آنزیمهای ALT و AST در بیماران دیابتی مشاهده شده بود [39, 40]. نیبلوم و همکاران نشان دادند که در بیماران مبتلا به بیماری کبد الکلی پیشرونده، آنزیمهای کبدی مانند AST و ALT افزایش مییابد [41]. میخک صدپر با افزایش آنزیمهای موجود در سیستم آنتیاکسیدانی (SOD، CAT، GPX) و کاهش استرس اکسیداتیو میتواند آسیب کبدی را کاهش دهد [42, 43]. همچنین، نتایج بافتشناسی کبد در این مطالعه نشان داد که عصاره میخک صدپر آسیب بافت کبدی ناشی از دیابت را کاهش میدهد.
نتیجهگیری
نتایج حاصل از این مطالعه نشان داد که عصاره میخک صدپر، دارای اثرات مفید در کاهش قند خون، استرس اکسیداتیو، کلسترول پلاسما، تریگلیسیرید و لیپوپروتئین با چگالی کم است. همچنین میخک صدپر به افزایش سطح انسولین خون و بهبود آسیب بافتی کبد کمک کرده و دارای اثرات مفید در جهت کاهش آسیب بافتی ناشی از دیابت است. بنابراین با توجه به این اثرات مفید گیاه میخک صدپر، میتوان از آن به عنوان داروی گیاهی مؤثر در کاهش و درمان عوارض ناشی از دیابت و تأثیر آنها بر بافت کبد، استفاده کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
کد اخلاق این پژوهش (IR.TBZMED.VCR.REC.1397.167) از کمیته اخلاق طرحهای پژوهشی دانشگاه علومپزشکی تبریز اخذ شده است.
حامی مالی
این مقاله محصول طرح پژوهشی درباره رتهای دیابتی و مصوب کمیته تحقیقات دانشجویی دانشگاه علومپزشکی تبریز بوده است و بدون دریافت کمک مالی انجام شده است.
مشارکت نویسندگان
ایده اصلی: طلا پورلک و منیره حلیمی؛ نگارش مقاله، تأیید نهایی مقاله: طلا پورلک، منیره حلیمی، طناز پورلک، پرهام معروفی، صابر قادر پور و عارفه شکوهی؛ جمعآوری و تفسیر داده ها: طلا پورلک، صابر قادر پور و عارفه شکوهی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
بدینوسیله از معاونت تحقیقات و فناوری دانشگاه علومپزشکی تبریز و کمیته تحقیقات دانشجویی علومپزشکی تبریز تشکر و قدردانی میشود.
References
1.Inzucchi SE, Sherwin RS. Goldman’s cecil medicine. Philadelphia: Saunders Elsevier; 2011. [DOI:10.1016/B978-1-4377-1604-7.00237-2]
2.American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2014; 37 Suppl 1:S81-90. [DOI:10.2337/dc14-S081] [PMID]
3.Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus. Provisional report of a WHO consultation. Diabetic Medicine. 1998; 15(7):539-53. DOI:10.1002/(SICI)1096-9136(199807)15:73.0.CO;2-S] [PMID]
4.Rajasekaran S, Sivagnanam K, Subramanian S. Antioxidant effect of Aloe vera gel extract in streptozotocin-induced diabetes in rats. Pharmacological Reports. 2005; 57(1):90-6. [DOI:10.1385/BTER:108:1-3:185]
5.Lans CA. Ethnomedicines used in Trinidad and Tobago for urinary problems and diabetes mellitus. Journal of Ethnobiology and Ethnomedicine. 2006; 2:45. [DOI:10.1186/1746-4269-2-45] [PMID] [PMCID]
6.Abtahi-Evari SH, Shokoohi M, Abbasi A, Rajabzade A, Shoorei H, Kalarestaghi H. Protective efect of Galega officinalis extract on streptozotocin-induced kidney damage and biochemical factor in diabetic rats. Crescent Journal of Medical and Biological Sciences. 2017; 4(3):108-14. https://www.researchgate.net/publication/318773339
7.Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease. Nature Reviews Immunology. 2011; 11(2):98-107. [DOI:10.1038/nri2925] [PMID]
8.Adefegha SA, Oboh G, Adefegha OM, Boligon AA, Athayde ML. Antihyperglycemic, hypolipidemic, hepatoprotective and antioxidative effects of dietary clove (Szyzgium aromaticum) bud powder in a high-fat diet/streptozotocin-induced diabetes rat model. Journal of the Science of Food and Agriculture. 2014; 94(13):2726-37. [DOI:10.1002/jsfa.6617] [PMID]
9.Maritim AC, Sanders RA, Watkins JB. Diabetes, oxidative stress, and antioxidants: A review. Journal of Biochemical and Molecular Toxicology. 2003; 17(1):24-38. [DOI:10.1002/jbt.10058] [PMID]
10.Mohamed J, Nazratun Nafizah AH, Zariyantey AH, Budin SB. Mechanisms of diabetes-induced liver damage: The role of oxidative stress and inflammation. Sultan Qaboos University Medical Journal. 2016; 16(2):e132-41. [DOI:10.18295/squmj.2016.16.02.002] [PMID] [PMCID]
11.Donadon V, Balbi M, Mas MD, Casarin P, Zanette G. Metformin and reduced risk of hepatocellular carcinoma in diabetic patients with chronic liver disease. Liver International. 2010; 30(5):750-8. [DOI:10.1111/j.1478-3231.2010.02223.x] [PMID]
12.Ukkola O, Erkkilä PH, Savolainen MJ, Kesäniemi YA. Lack of association between polymorphisms of catalase, copper-zinc Superoxide Dismutase (SOD), extracellular SOD and endothelial nitric oxide synthase genes and macroangiopathy in patients with type 2 diabetes mellitus. Journal of Internal Medicine. 2001; 249(5):451-9. [DOI:10.1046/j.1365-2796.2001.00828.x] [PMID]
13.Moghimian M, Abtahi-Evari SH, Shokoohi M, Amiri M, Soltani M. Effect of Syzygium aromaticum (clove) extract on seminiferous tubules and oxidative stress after testicular torsion in adult rats. Physiology and Pharmacology. 2017; 21(4):343-50. http://ppj.phypha.ir/article-1-1257-en.html
14.Lee KG, Shibamoto T. Inhibition of malonaldehyde formation from blood plasma oxidation by aroma extracts and aroma components isolated from clove and eucalyptus. Food and Chemical Toxicology. 2001; 39(12):1199-204. [DOI:10.1016/S0278-6915(01)00078-3]
15.Moghimian M, Abtahi-Eivary SH, Jajarmy N, Karimi Shahri M, Adabi J, Shokoohi M. Comparing the effect of flaxseed and fish oils on acute ischemia-reperfusion injury in the rat kidney. Crescent Journal of Medical and Biological Sciences. 2019; 6(1):6-12. http://www.cjmb.org/uploads/pdf/pdf_CJMB_143.pdf
16.Rajasekaran S, Ravi K, Sivagnanam K, Subramanian S. Beneficial effects of Aloe vera leaf gel extract on lipid profile status in rats with streptozotocin diabetes. Clinical and Experimental Pharmacology and Physiology. 2006; 33(3):232-7. [DOI:10.1111/j.1440-1681.2006.04351.x] [PMID]
17.Proks P, Reimann F, Green N, Gribble F, Ashcroft F. Sulfonylurea stimulation of insulin secretion. Diabetes. 2002; 51 Suppl 3:S368-76. [DOI:10.2337/diabetes.51.2007.S368] [PMID]
18.Kedar P, Chakrabarti CH. Effects of bittergourd (Momordica charantia) seed & glibenclamide in streptozotocin induced diabetes mellitus. Indian Journal of Experimental Biology. 1982; 20(3):232-5. [PMID]
19.Chaudhry ZR, Chaudhry SR, Naseer A, Chaudhry FR. Effect of Syzygium aromaticum (clove) extract on blood glucose level in streptozotocin induced diabetic rats. Pakistan Armed Forces Medical Journal. 2013; 63(3):323-8. https://inis.iaea.org/search/searchsinglerecord.aspx?recordsFor=SingleRecord&RN=45041146
20.Yadav UCS, Moorthy K, Baquer NZ. Effects of sodium-orthovanadate and Trigonella foenum-graecum seeds on hepatic and renal lipogenic enzymes and lipid profile during alloxan diabetes. Journal of Biosciences. 2004; 29(1):81-91. [DOI:10.1007/BF02702565] [PMID]
21.Mitra SK, Gopumadhavan S, Muralidhar TS, Anturlikar SD, Sujatha MB. Effect of D-400, a herbomineral preparation on lipid profile, glycated haemoglobin and glucose tolerance in streptozotocin induced diabetes in rats. Indian Journal of Experimental Biology. 1995; 33(10):798-800. [PMID]
22.al-Shamaony L, al-Khazraji SM, Twaij HA. Hypoglycaemic effect of Artemisia herba alba. II. Effect of a valuable extract on some blood parameters in diabetic animals. Journal of Ethnopharmacology. 1994; 43(3):167-71. [DOI:10.1016/0378-8741(94)90038-8] [PMID]
23.Jung CH, Ahn J, Jeon TI, Kim TW, Ha TY. Syzygium aromaticum ethanol extract reduces highfat diet-induced obesity in mice through downregulation of adipogenic and lipogenic gene expression. Experimental and Therapeutic Medicine. 2012; 4(3):409-14. [DOI:10.3892/etm.2012.609] [PMID] [PMCID]
24.Shyamala MP, Venukumar MR, Latha MS. Antioxidant potential of the Syzygium aromaticum (Gaertn.) Linn.(cloves) in rats fed with high fat diet. Indian Journal of Pharmacology. 2003; 35(2):99-103. https://www.researchgate.net/publication/266091697
25.Alessio HM, Goldfarb AH. Lipid peroxidation and scavenger enzymes during exercise: Adaptive response to training. Journal of Applied Physiology. 1988; 64(4):1333-6. [DOI:10.1152/jappl.1988.64.4.1333] [PMID]
26.Fujiwara Y, Kondo T, Murakami K, Kawakami Y. Decrease of the inhibition of lipid peroxidation by glutathione-dependent system in erythrocytes of non-insulin dependent diabetics. Klinische Wochenschrift. 1989; 67(6):336-41. [DOI:10.1007/BF01741388] [PMID]
27.Blokhina O, Virolainen E, Fagerstedt KV. Antioxidants, oxidative damage and oxygen deprivation stress: A review. Annals of Botany. 2003; 91 Spec No(2):179-94. [DOI:10.1093/aob/mcf118] [PMID] [PMCID]
28.Masella R, Di Benedetto R, Varì R, Filesi C, Giovannini C. Novel mechanisms of natural antioxidant compounds in biological systems: Involvement of glutathione and glutathione-related enzymes. The Journal of Nutritional Biochemistry. 2005; 16(10):577-86. [DOI:10.1016/j.jnutbio.2005.05.013] [PMID]
29.Yadav AS, Bhatnagar D. Modulatory effect of spice extracts on iron-induced lipid peroxidation in rat liver. Biofactors. 2007; 29(2-3):147-57. [DOI:10.1002/biof.552029205] [PMID]
30.Halliwell B. Superoxide-dependent formation of hydroxyl radicals in the presence of iron chelates: Is it a mechanism for hydroxyl radical production in biochemical systems? FEBS Letters. 1978; 92(2):321-6. [DOI:10.1016/0014-5793(78)80779-0] [PMID]
31.Nassar MI, Gaara AH, El-Ghorab AH, Farrag ARH. Chemical constituents of clove (Syzygium aromaticum, Fam. Myrtaceae) and their antioxidant activity. Revista Latinoamericana de Quimica. 2007; 35(3):47-57. https://www.researchgate.net/publication/228357516
32.Pulikottil SJ, Nath S. Potential of clove of Syzygium aromaticum in development of a therapeutic agent for periodontal disease: A review. South African Dental Journal. 2015; 70(3):108-15. http://www.scielo.org.za/scielo.php?script=sci_arttext&pid=S0011-85162015000300010
33.Van Acker ASBE, Van Den Berg DJ, Tromp MNJL, Griffioen DH, Van Bennekom WP, Van Der Vijgh WJF, et al. Structural aspects of antioxidant activity of flavonoids. Free Radical Biology and Medicine. 1996; 20(3):331-42. [DOI:10.1016/0891-5849(95)02047-0]
34.Shukri R, Mohamed S, Mustapha NM. Cloves protect the heart, liver and lens of diabetic rats. Food Chemistry. 2010; 122(4):1116-21. [DOI:10.1016/j.foodchem.2010.03.094]
35.Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: Role of oxidative stress. Circulation. 2002; 106(16):2067-72. [DOI:10.1161/01.CIR.0000034509.14906.AE] [PMID]
36.Ozdemır G, Ozden M, Maral H, Kuskay S, Cetinalp P, Tarkun I. Malondialdehyde, glutathione, glutathione peroxidase and homocysteine levels in type 2 diabetic patients with and without microalbuminuria. Annals of Clinical Biochemistry. 2005; 42(Pt 2):99-104. [DOI:10.1258/0004563053492838] [PMID]
37.Navarro VJ, Senior JR. Drug-related hepatotoxicity. New England Journal of Medicine. 2006; 354(7):731-9. [DOI:10.1056/NEJMra052270] [PMID]
38.Golub EE, Boesze-Battaglia K. The role of alkaline phosphatase in mineralization. Current Opinion in Orthopaedics. 2007; 18(5):444-8. [DOI:10.1097/BCO.0b013e3282630851]
39.Vozarova B, Stefan N, Lindsay RS, Saremi A, Pratley RE, Bogardus C, et al. High alanine aminotransferase is associated with decreased hepatic insulin sensitivity and predicts the development of type 2 diabetes. Diabetes. 2002; 51(6):1889-95. [DOI:10.2337/diabetes.51.6.1889] [PMID]
40.Hanley AJ, Williams K, Festa A, Wagenknecht LE, D’Agostino RB Jr, Kempf j, et al. Elevations in markers of liver injury and risk of type 2 diabetes: The insulin resistance atherosclerosis study. Diabetes. 2004; 53(10):2623-32. [DOI:10.2337/diabetes.53.10.2623] [PMID]
41.Nyblom H, Berggren U, Balldin J, Olsson R. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking. Alcohol and Alcoholism. 2004; 39(4):336-9. [DOI:10.1093/alcalc/agh074] [PMID]
42.Gülçin I, Elmastaş M, Aboul-Enein HY. Antioxidant activity of clove oil-A powerful antioxidant source. Arabian Journal of Chemistry. 2012; 5(4):489-99. [DOI:10.1016/j.arabjc.2010.09.016]
43.Sadeek EA, El-Razek FHA. The chemo-protective effect of turmeric, chili, cloves and cardamom on correcting iron overload-induced liver injury, oxidative stress and serum lipid profile in rat models. Journal of American Science. 2010; 6(10):702-12. http://www.jofamericanscience.org/journals/am-sci/am0610/82_3676am0610_702_712.pdf
متن کامل: (6976 مشاهده)
مقدمه
دیابت ملیتوس (DM)، یک بیماری متابولیک مزمن است که با افزایش قند خون، مشکلات عروقی، مشکلات عصبی [1] و غلظت بالای گلوکز خون به دلیل کاهش دفع انسولین یا مقاومت در برابر انسولین یا هر دو مشخص میشود [2، 3]. دو نوع دیابت وجود دارد: نوع 1 و 2. در دیابت نوع 1 یا دیابت وابسته به انسولین، سلولهای بتای لوزالمعده تخریب میشوند وترشح انسولین از این سلولها دچار اختلال میشود [4]. به طور معمول کمتر از 10 درصد بیماران دیابتی، به دیابت نوع 1 مبتلا هستند [5]. تعداد بیماران دیابتی در سال 2003 به 194 میلیون نفر در سنین بین 20 تا 79 سال رسیده بود. افزایش 50درصدی در سال 2010 قابل پیشبینی بود که بیشتر این موارد جدید در آفریقا و آسیا بودند [6]. شیوع دیابت نوع 2 نیز یکی از نگرانیهای سلامت عمومی است و در حدود 10 میلیون از بیماریهای مزمن و درصد معناداری از مرگومیرها را هرساله در جهان دربر میگیرد. بر اساس تخمینهای ارائهشده در حدود 5 الی 8 درصد افراد بزرگسال دنیا به دیابت مبتلا هستند. انجمن بینالمللی دیابت تعداد افراد مبتلا به دیابت نوع 2 را در سال2010، 285 میلیون نفر در دنیا گزارش کرد و پیشبینی میکند که این تعداد تا سال 2030 به 438 میلیون نفر برسد [7]. افراد دیابتی به دلیل سطح بالای گلوکز خون در معرض بیماریهای پیشرفته قلبیعروقی هستند [4]. شواهد نشان میدهند که استرس اکسیداتیو نقش اصلی در پاتوژنز هر دو نوع دیابت دارد. افزایش غیرمعمول رادیکالهای آزاد و کاهش همزمان مکانیسمهای محافظتی آنتیاکسیدانی میتواند منجر به آسیب دیدگی ارگانلهای سلولی، افزایش پراکسیداسیون لیپیدها و پیشرفت مقاومت به انسولین شود [8، 9].
هیپرگلیسمی مزمن میتواند ضایعات فراوان و جبرانناپذیری را در چشمها، اعصاب، کلیهها، قلب و عروق و سایر اعضای بدن به وجود آورد. کبد یکی از اندامهایی است که در بیماری دیابت دچار آسیب میشود [10]. کبد، اندامی مؤثر در حفظ و برقراری سطح گلوکز خون در محدوده طبیعی بوده و افزایش قند خون منجر به عدم تعادل در واکنشهای اکسیداسیون احیا در درون هپاتوسیتها میشود؛ به این صورت که هیپرگلیسمی از طریق افزایش تولید AGEs در تسهیل باعث تولید رادیکالهای آزاد از طریق اختلال در تولید زدایندههای سوپراکسید مثل ROS، درونزاد دسموتاز (SOD) و کاتالاز میشود؛ بدین ترتیب مشخص میشود که آسیب دیابتی کبد توسط فاکتورهای متعددی ایجاد شده و تنها با مهار هیپرگلیسمی قابل کنترل نیست [11].
در حیوانات دیابتی، فعالیت سوپراکسید دیسموتاز (SOD)، کاتالاز (CAT) و گلوتاتیون کاهش مییابد [9]. کاتالاز و SOD مهمترین آنزیمهای اکسیداتیو شناختهشده هستند. SOD که در بیشتر ارگانیسمهای هوازی موجود است، سوپراکسید را به پراکسید هیدروژن و اکسیژن در فضای سیتوپلاسمی تبدیل میکند و ممکن است از DNA و ارگانلهای درونسلولی در برابر صدمات ناشی از واسطههای اکسیژن فعال محافظت کند [12]. شواهد اخیر نشان میدهد که توجه به درمانهای سنتی گیاهی برای دیابت بسیار مهم است. گیاهان غالباً حاوی مقادیر قابل توجهی آنتیاکسیدانها از جمله توکوفرول (ویتامین E)، کاروتنوئیدها، اسید اسکوربیک (ویتامین C)، فلاونوئیدها و تاننها هستند و توصیه شده است که عمل آنتیاکسیدانی این گیاهان ممکن است یک خاصیت اساسی و مهم در درمان دیابت باشد [4].
میخک صدپر یک گیاه با جوانه ی معطر است که به طور کلی در آفریقا، آسیا و دیگر مناطق جهان استفاده میشود. میخک صدپرچندین تأثیر درمانی از خود نشان میدهد که از جمله آنها میتوان به اثرات آنتیباکتریال، ضدقارچ و تقویت سیستم کلیوی اشاره کرد و به طور سنتی این گیاه به عنوان یک ماده نگهدارنده و ضدمیکروبی در مواد غذایی مورد استفاده قرار میگیرد [8، 13]. در مطالعهای تأثیر میخک صدپر روی کاهش سطح گلوکز و افزایش انسولین سرم و سطح آنزیمهای SOD ،CAT مورد بررسی قرار گرفته است [8]. همچنین، اثرات آنتیاکسیدانی میخک صدپر و توانایی آن در کاهش میزان مالون دیآلدئید (MA) مورد مطالعه قرار گرفته است [14]. هدف از انجام این مطالعه بررسی تأثیر میخک صدپر بر آسیب سلولهای کبدی و استرس اکسیداتیو ناشی از دیابت در موشهای صحرایی بزرگسال است.
مواد و روشها
برای این مطالعه از 28 موش ماده با وزن متوسط 200-250 گرم استفاده شد. حیوانات از مؤسسه رازی مشهد خریداری شده و در شرایط استاندارد نگهداری شدند (دمای 25 درجه سانتیگراد، و 12/12 ساعت چرخه روشنایی و تاریکی). در طی آزمایش، موشهای صحرایی دسترسی آزاد به آب و غذا داشتند. کلیه مراحل تحقیقاتی این مطالعه مطابق با دستورالعملهای مربوط به نگهداری و استفاده از حیوانات آزمایشگاهی دانشگاه علومپزشکی گناباد انجام شده است.
موشهای صحرایی به طور تصادفی به یک گروه کنترل سالم (n=7) و سه گروه آزمایش (n=21) تقسیم شدند. برای القای دیابت در گروههای آزمایش، تزریق داخلصفاقی تکدُز 50 میلیگرم بر کیلوگرم استرپتوزوتوسین (STZ) (سیگما) حل شده در 5 میلیمتر بافر سیترات 0/1 مولار (pH=4/5) انجام شد [6]. در گروه کنترل (نرمال)، به همان اندازه بافر سیترات به جای STZ به صورت تکدُز تزریق شد. 72 ساعت پس از تزریق، برای تأیید دیابتی شدن میزان قند خون موشهای صحرایی اندازهگیری شد و قند خون بیش از 250 میلیگرم بر دسیلیتر، نشانه دیابتی شدن در نظر گرفته شد.
موشهای صحرایی دیابتی به ترتیب زیر تقسیم شدند: الف) گروه کنترل سالم؛ ب) گروه کنترل دیابتی (DC) که نرمال سالین به عنوان حلال دریافت کرد؛ ج) موشهای صحرایی دیابتی درمانشده با 50 میلیگرم بر کیلوگرم از عصاره هیدروالکلی عصاره میخک صدپر؛ د) موشهای صحرایی که با 5 میلیگرم بر کیلوگرم گلیبنکلامید به عنوان یک داروی استاندارد (DG) درمان شدند. درمان یکبار در روز به مدت 21 روز برای همه گروهها، به صورت تزریق داخلصفاقی انجام شد. پس از مدتزمان درمان (21 روز)، موشهای صحرایی بیهوش شدند و نمونه خون آنها گرفته شد و کلیهها، پانکراس و کبد در دمای منهای 70 درجه سانتیگراد نگهداری شدند. برای آزمایش گلوکز، انسولین، پروفایل چربی، برخی از نشانگرهای استرس اکسیداتیو و آنزیمهای آنتیاکسیدان از نمونه خون استفاده شد. نمونههای سرم آنها در دمای منهای 70 درجه سانتیگراد نگهداری شدند.
نحوه عصارهگیری میخک: برای استخراج عصاره هیدروالکلی میخک، ابتدا جوانه خشکشده میخک تهیه و سپس پودر شد. بعد در الکل مطلق و آب مقطر به میزان 50 درصد ترکیب شد و به مدت 48 ساعت توسط دستگاه شیکر تکان داده شد و پس از آن فیلتر شد و با دور هزار دور بر دقیقه سانتریفیوژ شد. پس از تبخیر آب و الکل پودر بهدستآمده به عنوان عصاره را در نرمال سالین حل کردیم و با دُز 4 میلگرم بر کیلوگرم استفاده شد.
فعالیت SOD با استفاده از روش کیت RANSOD (UK) سنجش شد. MDA با قرار دادن پلاسما در یک لوله آزمایش حاوی اسید استیک گلاسیال اندازهگیری شد که به آن تیوباربیتوریک اسید 1 درصد و 2 درصد NaOH اضافه شد. حجم مساوی (600 میکرولیتر در لیتر) محلولهای اسید استیک گلاسیال و تیوباربیتوریک اسید به 40 میکرولیتر پلاسما اضافه شد. سپس لوله آزمایش حاوی مخلوط، به مدت 15 دقیقه در آب جوش قرار داده شد. پس از سرد شدن، جذب در 532 نانومتر خوانده شد. سطح MDA با استفاده ازضریب جذب MDA-TBA محاسبه شد (ε = 1.56 × 105 Cm-1M-1) [13، 15].
سطح سرمی GPT با استفاده از کیت پارسآزمون (ایران) اندازهگیری شد. درنهایت، دادههای حاصل از این آزمایش با آزمون آماری آنالیز واریانس یکطرفه تجزیه و تحلیل شدند و از آزمون توکی برای تعیین گروههای دارای اختلاف معنیدار استفاده شد (P<0/05). در این مطالعه دادهها به صورت میانگین و انحراف معیار ارائه شد.
یافتهها
قندخون ناشتا
میزان قند خون ناشتا در گروه DC در مقایسه با گروه کنترل به طور معنیداری افزایش یافت (0/05>P). همچنین میزان قند خون ناشتا در گروه های DC ،DG و DSA کاهش معنیداری در گروه های DG و DSA در مقایسه با گروه DC نشان داد (0/05>P) (تصویر شماره 1).
دیابت ملیتوس (DM)، یک بیماری متابولیک مزمن است که با افزایش قند خون، مشکلات عروقی، مشکلات عصبی [1] و غلظت بالای گلوکز خون به دلیل کاهش دفع انسولین یا مقاومت در برابر انسولین یا هر دو مشخص میشود [2، 3]. دو نوع دیابت وجود دارد: نوع 1 و 2. در دیابت نوع 1 یا دیابت وابسته به انسولین، سلولهای بتای لوزالمعده تخریب میشوند وترشح انسولین از این سلولها دچار اختلال میشود [4]. به طور معمول کمتر از 10 درصد بیماران دیابتی، به دیابت نوع 1 مبتلا هستند [5]. تعداد بیماران دیابتی در سال 2003 به 194 میلیون نفر در سنین بین 20 تا 79 سال رسیده بود. افزایش 50درصدی در سال 2010 قابل پیشبینی بود که بیشتر این موارد جدید در آفریقا و آسیا بودند [6]. شیوع دیابت نوع 2 نیز یکی از نگرانیهای سلامت عمومی است و در حدود 10 میلیون از بیماریهای مزمن و درصد معناداری از مرگومیرها را هرساله در جهان دربر میگیرد. بر اساس تخمینهای ارائهشده در حدود 5 الی 8 درصد افراد بزرگسال دنیا به دیابت مبتلا هستند. انجمن بینالمللی دیابت تعداد افراد مبتلا به دیابت نوع 2 را در سال2010، 285 میلیون نفر در دنیا گزارش کرد و پیشبینی میکند که این تعداد تا سال 2030 به 438 میلیون نفر برسد [7]. افراد دیابتی به دلیل سطح بالای گلوکز خون در معرض بیماریهای پیشرفته قلبیعروقی هستند [4]. شواهد نشان میدهند که استرس اکسیداتیو نقش اصلی در پاتوژنز هر دو نوع دیابت دارد. افزایش غیرمعمول رادیکالهای آزاد و کاهش همزمان مکانیسمهای محافظتی آنتیاکسیدانی میتواند منجر به آسیب دیدگی ارگانلهای سلولی، افزایش پراکسیداسیون لیپیدها و پیشرفت مقاومت به انسولین شود [8، 9].
هیپرگلیسمی مزمن میتواند ضایعات فراوان و جبرانناپذیری را در چشمها، اعصاب، کلیهها، قلب و عروق و سایر اعضای بدن به وجود آورد. کبد یکی از اندامهایی است که در بیماری دیابت دچار آسیب میشود [10]. کبد، اندامی مؤثر در حفظ و برقراری سطح گلوکز خون در محدوده طبیعی بوده و افزایش قند خون منجر به عدم تعادل در واکنشهای اکسیداسیون احیا در درون هپاتوسیتها میشود؛ به این صورت که هیپرگلیسمی از طریق افزایش تولید AGEs در تسهیل باعث تولید رادیکالهای آزاد از طریق اختلال در تولید زدایندههای سوپراکسید مثل ROS، درونزاد دسموتاز (SOD) و کاتالاز میشود؛ بدین ترتیب مشخص میشود که آسیب دیابتی کبد توسط فاکتورهای متعددی ایجاد شده و تنها با مهار هیپرگلیسمی قابل کنترل نیست [11].
در حیوانات دیابتی، فعالیت سوپراکسید دیسموتاز (SOD)، کاتالاز (CAT) و گلوتاتیون کاهش مییابد [9]. کاتالاز و SOD مهمترین آنزیمهای اکسیداتیو شناختهشده هستند. SOD که در بیشتر ارگانیسمهای هوازی موجود است، سوپراکسید را به پراکسید هیدروژن و اکسیژن در فضای سیتوپلاسمی تبدیل میکند و ممکن است از DNA و ارگانلهای درونسلولی در برابر صدمات ناشی از واسطههای اکسیژن فعال محافظت کند [12]. شواهد اخیر نشان میدهد که توجه به درمانهای سنتی گیاهی برای دیابت بسیار مهم است. گیاهان غالباً حاوی مقادیر قابل توجهی آنتیاکسیدانها از جمله توکوفرول (ویتامین E)، کاروتنوئیدها، اسید اسکوربیک (ویتامین C)، فلاونوئیدها و تاننها هستند و توصیه شده است که عمل آنتیاکسیدانی این گیاهان ممکن است یک خاصیت اساسی و مهم در درمان دیابت باشد [4].
میخک صدپر یک گیاه با جوانه ی معطر است که به طور کلی در آفریقا، آسیا و دیگر مناطق جهان استفاده میشود. میخک صدپرچندین تأثیر درمانی از خود نشان میدهد که از جمله آنها میتوان به اثرات آنتیباکتریال، ضدقارچ و تقویت سیستم کلیوی اشاره کرد و به طور سنتی این گیاه به عنوان یک ماده نگهدارنده و ضدمیکروبی در مواد غذایی مورد استفاده قرار میگیرد [8، 13]. در مطالعهای تأثیر میخک صدپر روی کاهش سطح گلوکز و افزایش انسولین سرم و سطح آنزیمهای SOD ،CAT مورد بررسی قرار گرفته است [8]. همچنین، اثرات آنتیاکسیدانی میخک صدپر و توانایی آن در کاهش میزان مالون دیآلدئید (MA) مورد مطالعه قرار گرفته است [14]. هدف از انجام این مطالعه بررسی تأثیر میخک صدپر بر آسیب سلولهای کبدی و استرس اکسیداتیو ناشی از دیابت در موشهای صحرایی بزرگسال است.
مواد و روشها
برای این مطالعه از 28 موش ماده با وزن متوسط 200-250 گرم استفاده شد. حیوانات از مؤسسه رازی مشهد خریداری شده و در شرایط استاندارد نگهداری شدند (دمای 25 درجه سانتیگراد، و 12/12 ساعت چرخه روشنایی و تاریکی). در طی آزمایش، موشهای صحرایی دسترسی آزاد به آب و غذا داشتند. کلیه مراحل تحقیقاتی این مطالعه مطابق با دستورالعملهای مربوط به نگهداری و استفاده از حیوانات آزمایشگاهی دانشگاه علومپزشکی گناباد انجام شده است.
موشهای صحرایی به طور تصادفی به یک گروه کنترل سالم (n=7) و سه گروه آزمایش (n=21) تقسیم شدند. برای القای دیابت در گروههای آزمایش، تزریق داخلصفاقی تکدُز 50 میلیگرم بر کیلوگرم استرپتوزوتوسین (STZ) (سیگما) حل شده در 5 میلیمتر بافر سیترات 0/1 مولار (pH=4/5) انجام شد [6]. در گروه کنترل (نرمال)، به همان اندازه بافر سیترات به جای STZ به صورت تکدُز تزریق شد. 72 ساعت پس از تزریق، برای تأیید دیابتی شدن میزان قند خون موشهای صحرایی اندازهگیری شد و قند خون بیش از 250 میلیگرم بر دسیلیتر، نشانه دیابتی شدن در نظر گرفته شد.
موشهای صحرایی دیابتی به ترتیب زیر تقسیم شدند: الف) گروه کنترل سالم؛ ب) گروه کنترل دیابتی (DC) که نرمال سالین به عنوان حلال دریافت کرد؛ ج) موشهای صحرایی دیابتی درمانشده با 50 میلیگرم بر کیلوگرم از عصاره هیدروالکلی عصاره میخک صدپر؛ د) موشهای صحرایی که با 5 میلیگرم بر کیلوگرم گلیبنکلامید به عنوان یک داروی استاندارد (DG) درمان شدند. درمان یکبار در روز به مدت 21 روز برای همه گروهها، به صورت تزریق داخلصفاقی انجام شد. پس از مدتزمان درمان (21 روز)، موشهای صحرایی بیهوش شدند و نمونه خون آنها گرفته شد و کلیهها، پانکراس و کبد در دمای منهای 70 درجه سانتیگراد نگهداری شدند. برای آزمایش گلوکز، انسولین، پروفایل چربی، برخی از نشانگرهای استرس اکسیداتیو و آنزیمهای آنتیاکسیدان از نمونه خون استفاده شد. نمونههای سرم آنها در دمای منهای 70 درجه سانتیگراد نگهداری شدند.
نحوه عصارهگیری میخک: برای استخراج عصاره هیدروالکلی میخک، ابتدا جوانه خشکشده میخک تهیه و سپس پودر شد. بعد در الکل مطلق و آب مقطر به میزان 50 درصد ترکیب شد و به مدت 48 ساعت توسط دستگاه شیکر تکان داده شد و پس از آن فیلتر شد و با دور هزار دور بر دقیقه سانتریفیوژ شد. پس از تبخیر آب و الکل پودر بهدستآمده به عنوان عصاره را در نرمال سالین حل کردیم و با دُز 4 میلگرم بر کیلوگرم استفاده شد.
فعالیت SOD با استفاده از روش کیت RANSOD (UK) سنجش شد. MDA با قرار دادن پلاسما در یک لوله آزمایش حاوی اسید استیک گلاسیال اندازهگیری شد که به آن تیوباربیتوریک اسید 1 درصد و 2 درصد NaOH اضافه شد. حجم مساوی (600 میکرولیتر در لیتر) محلولهای اسید استیک گلاسیال و تیوباربیتوریک اسید به 40 میکرولیتر پلاسما اضافه شد. سپس لوله آزمایش حاوی مخلوط، به مدت 15 دقیقه در آب جوش قرار داده شد. پس از سرد شدن، جذب در 532 نانومتر خوانده شد. سطح MDA با استفاده ازضریب جذب MDA-TBA محاسبه شد (ε = 1.56 × 105 Cm-1M-1) [13، 15].
سطح سرمی GPT با استفاده از کیت پارسآزمون (ایران) اندازهگیری شد. درنهایت، دادههای حاصل از این آزمایش با آزمون آماری آنالیز واریانس یکطرفه تجزیه و تحلیل شدند و از آزمون توکی برای تعیین گروههای دارای اختلاف معنیدار استفاده شد (P<0/05). در این مطالعه دادهها به صورت میانگین و انحراف معیار ارائه شد.
یافتهها
قندخون ناشتا
میزان قند خون ناشتا در گروه DC در مقایسه با گروه کنترل به طور معنیداری افزایش یافت (0/05>P). همچنین میزان قند خون ناشتا در گروه های DC ،DG و DSA کاهش معنیداری در گروه های DG و DSA در مقایسه با گروه DC نشان داد (0/05>P) (تصویر شماره 1).
سطح سرمی انسولین
در همه گروههای DC، DG و DSA در مقایسه با گروه کنترل، میزان انسولین سرم به طور معنیداری کاهش یافته است (0/05>P) و همچنین در گروههای DG و DSA نسبت به گروه DC میزان انسولین افزایش یافته است. این افزایش در گروه DSA معنیدار بود (0/05>P) (تصویر شماره 2).
سطح سرمی پروفایل چربی
سطح سرمی کلسترول
سطح کلسترول سرم در گروه DC به طور معنیداری بالاتر از گروه کنترل بود (0/05>P). همچنین میزان کلسترول در گروههای DG و DSA در مقایسه با گروه DC به طور معنیداری کاهش یافت (0/05>P) (جدول شماره 1).
.jpg)
سطح سرمی لیپوپروتئین کمچگالی (LDL)
در گروه DC نسبت به گروه کنترل سطح سرمی LDL به میزان کمی افزایش یافته است (0/05>P) همچنین، سطح LDL در گروههای DG و DSA در مقایسه با گروه DC به طور معنیداری کاهش یافته است (0/05>P) (جدول شماره 1).
سطح سرمی لیپوپروتئین با چگالی بالا (HDL)
سطح سرمی HDL در گروه DC نسبت به گروه کنترل به طور معنیداری کاهش یافته است (0/05>P). همچنین در گروههای DG و DSA نسبت به گروه DC به طور معنیداری افزایش یافت (0/05>P). از طرف دیگر، سطح HDL در گروه DSA به طور قابل توجهی بالاتر از گروه کنترل بود (0/05>P) (جدول شماره 1).
سطح سرمی تریگلیسیرید (TG)
سطح سرمی TG در گروه DC نسبت به گروه کنترل به طور معنیداری افزایش یافته است (0/05>P). علاوه بر این، سطح TG در گروه DSA در مقایسه با گروه DC به طور قابل توجهی کاهش یافته است (0/05>P). (جدول شماره 1).
مارکرهای استرس اکسیداتیو
در جدول شماره 2 سطح سرمی GPx ،SOD و MDA نشان داده شده است.
.jpg)
فعالیت آنزیم GPx و SOD در گروه کنترل دیابتی به طور قابل توجهی پایینتر از گروه سالم بود (0/05>P). اما، درمان با عصاره میخک فعالیت سرمی GPx و SOD را در مقایسه با گروه دیابت کنترل افزایش داد (0/05>P). در گروه کنترل دیابتی سطح سرمی MDA نسبت به گروه سالم به طور معنیداری افزایش یافت (0/05>P). از طرفی در گروههای تحت درمان با عصاره میخک صدپر نسبت به گروه دیابت کنترل به طور معنیداری کاهش یافت (0/05>P) (جدول شماره 2).
آسیبشناسی بافتی کبد
بافت کبد بهدستآمده از گروه سالم، از نظر هیستولوژیک طبیعی بود. مطالعات بافتشناسی نشان داد که دیابت منجر به تغییرات دژنراتیو مانند ادم، پارگی، خونریزی در رگهای مرکزی، گشاد شدن در سینوسوئیدها و هستههای پیکنوتیک میشود. اما، تغییرات دژنراتیو ذکر شده در گروههای درمانی کاهش یافته است (تصویر شماره 3).
بحث
استرپتوزوتوسین ترکیبی است که معمولاً برای القای دیابت نوع 1 در موشهای صحرایی استفاده میشود [16]. استرپتوزوتوسین با کاهش سریع سلولهای بتای لوزالمعده باعث ایجاد دیابت شده، که درنهایت منجر به کاهش ترشح انسولین میشود. بهخوبی مشخص شده است که گلیبنکلامید با افزایش ترشح انسولین از سلولهای بتای موجود در لوزالمعده، باعث ایجاد هیپوگلیسمی میشود. این ترکیب در دیابت متوسط ناشی از STZ (تعدادی از سلولهای بتا هنوز سالم اند) فعال است، در حالی که در دیابت شدید STZ (که تقریباً در تمام سلولهای بتا از بین رفتهاند) غیرفعال میشود [17]. نتایج ما نشان داد که گلیبنکلامید سطح قند خون ناشتا (FBS) را در حیوانات هیپرگلیسمیک کاهش میدهد، بنابراین وضعیت دیابت در حیوانات مورد استفاده متوسط بود. اثرات هیپوگلیسمی عصارههای گیاهی به میزان تخریب سلولهای بتای لوزالمعده بستگی دارد. درمان موشهای صحرایی دیابتی متوسط با عصاره گیاه دارویی، منجر به فعال شدن سلولهای بتا و افزایش تولید انسولین شد [18]. فعالیت آنتیهیپرگلیسمیک عصاره میخک صدپر، با افزایش انسولین پلاسما همراه بود که نشان میدهد فعالیت آنتیهیپرگلیسمیک عصاره میخک صدپر میتواند به دلیل فعالیت انسولینزای این عصاره باشد. افزایش سطح انسولین مشاهدهشده در مطالعه حاضر نشان داد که عصاره میخک صدپر میتواند منجر به ترشح انسولین از بقایای سلولهای بتا و یا سلولهای بتای بازسازیشده شود. همچنین، نتایج این مطالعه نشان داد عصاره میخک صدپر در اثر افزایش ترشح انسولین، میزان قند خون ناشتا را به طور معنیداری کاهش میدهد [19].
دیابت در تعداد زیادی از مسیرهای متابولیکی از جمله متابولیسم لیپیدها تأثیر میگذارد. کمبود انسولین (دیابت نوع 1) یا کاهش عملکرد انسولین (دیابت نوع 2) منجر به کاهش مصرف گلوکز توسط بافت هایی که به انسولین نیاز دارند (مانند کبد) و همچنین افزایش تولید گلوکز از طریق افزایش میزان گلوکونوژنز شده که درنهایت منجر به افت قند خون میشود. در اثر افزایش گلوکز و کاهش سطح انسولین در پلاسمای خون، تنظیم کبدی متابولیسم لیپید بسیار تغییر میکند. از آنجا که انسولین تنظیمکننده مهمی در بسیاری از آنزیمهای درگیر در لیپولیز و لیپوژنز است، کمبود آن باعث ایجاد تغییرات عمدهای در فعالیت این آنزیمها میشود و درنتیجه بر متابولیسم کلی چربیها و پروفایل چربی در بافتهای مختلف تأثیر میگذارد [20].
در دیابت ناشی از STZ، افزایش سطح قند خون معمولاً با افزایش کلسترول پلاسما، تریگلیسیرید و لیپوپروتئین با چگالی کم (LDL) همراه است و لیپوپروتئین با چگالی زیاد (HDL) کاهش مییابد [21]. فعالسازی لیپاز حساس به هورمون در هنگام کمبود انسولین با آزادسازی اسیدهای چرب آزاد (FFAs) از بافت چربی همراه است [22]. بنابراین، اسیدهای چرب اضافی تولیدشده توسط دیابت ناشی از STZ در پلاسما، تبدیل اسیدهای چرب اضافی به فسفولیپیدها و کلسترول را در کبد تقویت میکند. این دو ماده به همراه تریگلیسیریدهای اضافی که در کبد تشکیل شده است، ممکن است به شکل لیپوپروتئین به درون خون تخلیه شوند [16].
مشاهدات ما نشان داد که عصاره میخک بهتنهایی و همراه با گلیبنکلامید باعث کاهش معنیدار کلسترول پلاسما، تریگلیسیرید و لیپوپروتئین با چگالی کم در گروههای دیگر نسبت به گروه کنترل دیابتی شد. همچنین، عصاره میخک صدپر باعث افزایش لیپوپروتئین با چگالی زیاد نسبت به گروه کنترل دیابتی شد (جدول شماره 1). عصاره میخک صدپر احتمالاً از طریق کنترل متابولیسم لیپید، وضعیت لیپید پلاسما را به سطح نرمال برگرداند. این نتایج، در توافق با نتایج مطالعههای گذشته بود [23، 24].
مشاهدات ما نشان داد میخک صدپر باعث افزایش معنیدار GPx، و SOD در گروههای دیگر نسبت به گروه کنترل شد (جدول شماره 2). یکی از روبندههای سیتوپلاسمی رادیکالها که میتواند رادیکالهای آزاد را کاهش دهد گلوتاتیون (GSH) است [25]. به طور کلی اعتقاد بر این است که اثر محافظتی GSH در برابر تجزیه اکسیداتیو لیپیدها، از طریق GPx با کاهش هیدروپراکسیدهای تشکیلشده درونزای اسیدهای چرب اشباع نشده (PUFA) و تبدیل به مشتقات هیدروکسیل انجام میشود [26]. گلوتاتیون (GSH) میتواند با تشکیل کاتالیزورهای فلزدار به طور موقت، شکستن واکنشهای زنجیرهای، کاهش غلظت گونههای واکنشدهنده اکسیژن (ROS) و افزایش سطح آنزیمهای دخیل در سیستم آنتیاکسیدانی (SOD ،CAT ،GPx و GST) مانع از تولید رادیکال آزاد شود [27، 28]. سلنیوم یک کوفاکتور مهم برای آنزیم SOD است [29] و استفاده از عصاره عصاره میخک صدپر در موشهای صحرایی باعث افزایش سلنیوم، کاهش استرس اکسیداتیو و آسیب کبدی میشود. نتایج مشابه در مطالعه آدفگا و همکاران مشاهده شد [8] که نشان میداد واکنش فنتون ترکیبی از H2O2 و Fe2+ است که به طور مکرر برای القای واکنشهای لیپوکسیژناز (LPO) استفاده میشود [30]. LPO هیدروژن را که قدرتمندترین اکسیدان در سیستم بیولوژیکی است از PUFA و رادیکال هیدروکسیل آزاد میکند و میتواند از هیدروژن جداسازی شده از PUFA استفاده کرده و باعث افزایش استرس اکسیداتیو شود [29].
فعالیت آنتیاکسیدانی میخک صدپر ممکن است به دلیل ترکیبات فنولیک مانند اوژنول، اوژنول استات و تیمول باشد [31]. میخک صدپر میتواند از طریق پاک کردن رادیکالهای آزاد، شلات کردن یونهای موقت فلز، مهار آنزیمهای اکسیدان و یا از طریق ترمیم α-توکوفرول و رادیکال α-توکوفوکسسیل، از آسیب دیدن سلولها جلوگیری کند [32]. همچنین، فلاونوئیدها میتوانند رادیکالهای O2 ،OH و پراکسیل را از بین ببرند و از فعالیت LPO جلوگیری کنند [33]. میخک صدپر میتواند SOD ،GPx ،GSH را افزایش داده و MDA را کاهش دهد [34]. هایپرگلیسمی و هایپرلیپیدمی در بیماران دیابتی با افزایش استرس اکسیداتیو همراه است [35] و افزایش سطح MDA در موشهای صحرایی دیابتی نوع 2 نشان میدهد که پراکسیداسیون لیپید افزایشیافته منجر به آسیب بافتی و عدم توانایی مکانیسمهای دفاعی آنتیاکسیدانی برای جلوگیری از حمله رادیکال آزاد میشود که ممکن است منجر به نشت آنزیمها و متابولیتها به گردش خون شود [36].
افزایش سطح آنزیمهایی مانند ALT و AST، نشانگر آسیبهای کبدی است و ارزیابی AST و ALT، به ترتیب شاخصی از وضعیت کبدی و سلولهای نکروتیک را نشان میدهد [37]. همچنین سطح غیرطبیعی آلکالین فسفاتاز در خون میتواند نشاندهنده مشکلاتی مربوط به کبد و یا استخوانها باشد [38]. در مطالعه حاضر، افزایش سطح AST، ALT و ALP در گروه دیابتی نسبت به گروه کنترل به طور معنیداری بالا بود. همچنین در گروه درمانی با میخک صدپر کاهش معنیداری در سطح AST و ALT نسبت به گروه دیابتی مشاهده شد. در مطالعات گذشته، افزایش میزان آنزیمهای ALT و AST در بیماران دیابتی مشاهده شده بود [39, 40]. نیبلوم و همکاران نشان دادند که در بیماران مبتلا به بیماری کبد الکلی پیشرونده، آنزیمهای کبدی مانند AST و ALT افزایش مییابد [41]. میخک صدپر با افزایش آنزیمهای موجود در سیستم آنتیاکسیدانی (SOD، CAT، GPX) و کاهش استرس اکسیداتیو میتواند آسیب کبدی را کاهش دهد [42, 43]. همچنین، نتایج بافتشناسی کبد در این مطالعه نشان داد که عصاره میخک صدپر آسیب بافت کبدی ناشی از دیابت را کاهش میدهد.
نتیجهگیری
نتایج حاصل از این مطالعه نشان داد که عصاره میخک صدپر، دارای اثرات مفید در کاهش قند خون، استرس اکسیداتیو، کلسترول پلاسما، تریگلیسیرید و لیپوپروتئین با چگالی کم است. همچنین میخک صدپر به افزایش سطح انسولین خون و بهبود آسیب بافتی کبد کمک کرده و دارای اثرات مفید در جهت کاهش آسیب بافتی ناشی از دیابت است. بنابراین با توجه به این اثرات مفید گیاه میخک صدپر، میتوان از آن به عنوان داروی گیاهی مؤثر در کاهش و درمان عوارض ناشی از دیابت و تأثیر آنها بر بافت کبد، استفاده کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
کد اخلاق این پژوهش (IR.TBZMED.VCR.REC.1397.167) از کمیته اخلاق طرحهای پژوهشی دانشگاه علومپزشکی تبریز اخذ شده است.
حامی مالی
این مقاله محصول طرح پژوهشی درباره رتهای دیابتی و مصوب کمیته تحقیقات دانشجویی دانشگاه علومپزشکی تبریز بوده است و بدون دریافت کمک مالی انجام شده است.
مشارکت نویسندگان
ایده اصلی: طلا پورلک و منیره حلیمی؛ نگارش مقاله، تأیید نهایی مقاله: طلا پورلک، منیره حلیمی، طناز پورلک، پرهام معروفی، صابر قادر پور و عارفه شکوهی؛ جمعآوری و تفسیر داده ها: طلا پورلک، صابر قادر پور و عارفه شکوهی.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
بدینوسیله از معاونت تحقیقات و فناوری دانشگاه علومپزشکی تبریز و کمیته تحقیقات دانشجویی علومپزشکی تبریز تشکر و قدردانی میشود.
References
1.Inzucchi SE, Sherwin RS. Goldman’s cecil medicine. Philadelphia: Saunders Elsevier; 2011. [DOI:10.1016/B978-1-4377-1604-7.00237-2]
2.American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2014; 37 Suppl 1:S81-90. [DOI:10.2337/dc14-S081] [PMID]
3.Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: Diagnosis and classification of diabetes mellitus. Provisional report of a WHO consultation. Diabetic Medicine. 1998; 15(7):539-53. DOI:10.1002/(SICI)1096-9136(199807)15:73.0.CO;2-S] [PMID]
4.Rajasekaran S, Sivagnanam K, Subramanian S. Antioxidant effect of Aloe vera gel extract in streptozotocin-induced diabetes in rats. Pharmacological Reports. 2005; 57(1):90-6. [DOI:10.1385/BTER:108:1-3:185]
5.Lans CA. Ethnomedicines used in Trinidad and Tobago for urinary problems and diabetes mellitus. Journal of Ethnobiology and Ethnomedicine. 2006; 2:45. [DOI:10.1186/1746-4269-2-45] [PMID] [PMCID]
6.Abtahi-Evari SH, Shokoohi M, Abbasi A, Rajabzade A, Shoorei H, Kalarestaghi H. Protective efect of Galega officinalis extract on streptozotocin-induced kidney damage and biochemical factor in diabetic rats. Crescent Journal of Medical and Biological Sciences. 2017; 4(3):108-14. https://www.researchgate.net/publication/318773339
7.Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease. Nature Reviews Immunology. 2011; 11(2):98-107. [DOI:10.1038/nri2925] [PMID]
8.Adefegha SA, Oboh G, Adefegha OM, Boligon AA, Athayde ML. Antihyperglycemic, hypolipidemic, hepatoprotective and antioxidative effects of dietary clove (Szyzgium aromaticum) bud powder in a high-fat diet/streptozotocin-induced diabetes rat model. Journal of the Science of Food and Agriculture. 2014; 94(13):2726-37. [DOI:10.1002/jsfa.6617] [PMID]
9.Maritim AC, Sanders RA, Watkins JB. Diabetes, oxidative stress, and antioxidants: A review. Journal of Biochemical and Molecular Toxicology. 2003; 17(1):24-38. [DOI:10.1002/jbt.10058] [PMID]
10.Mohamed J, Nazratun Nafizah AH, Zariyantey AH, Budin SB. Mechanisms of diabetes-induced liver damage: The role of oxidative stress and inflammation. Sultan Qaboos University Medical Journal. 2016; 16(2):e132-41. [DOI:10.18295/squmj.2016.16.02.002] [PMID] [PMCID]
11.Donadon V, Balbi M, Mas MD, Casarin P, Zanette G. Metformin and reduced risk of hepatocellular carcinoma in diabetic patients with chronic liver disease. Liver International. 2010; 30(5):750-8. [DOI:10.1111/j.1478-3231.2010.02223.x] [PMID]
12.Ukkola O, Erkkilä PH, Savolainen MJ, Kesäniemi YA. Lack of association between polymorphisms of catalase, copper-zinc Superoxide Dismutase (SOD), extracellular SOD and endothelial nitric oxide synthase genes and macroangiopathy in patients with type 2 diabetes mellitus. Journal of Internal Medicine. 2001; 249(5):451-9. [DOI:10.1046/j.1365-2796.2001.00828.x] [PMID]
13.Moghimian M, Abtahi-Evari SH, Shokoohi M, Amiri M, Soltani M. Effect of Syzygium aromaticum (clove) extract on seminiferous tubules and oxidative stress after testicular torsion in adult rats. Physiology and Pharmacology. 2017; 21(4):343-50. http://ppj.phypha.ir/article-1-1257-en.html
14.Lee KG, Shibamoto T. Inhibition of malonaldehyde formation from blood plasma oxidation by aroma extracts and aroma components isolated from clove and eucalyptus. Food and Chemical Toxicology. 2001; 39(12):1199-204. [DOI:10.1016/S0278-6915(01)00078-3]
15.Moghimian M, Abtahi-Eivary SH, Jajarmy N, Karimi Shahri M, Adabi J, Shokoohi M. Comparing the effect of flaxseed and fish oils on acute ischemia-reperfusion injury in the rat kidney. Crescent Journal of Medical and Biological Sciences. 2019; 6(1):6-12. http://www.cjmb.org/uploads/pdf/pdf_CJMB_143.pdf
16.Rajasekaran S, Ravi K, Sivagnanam K, Subramanian S. Beneficial effects of Aloe vera leaf gel extract on lipid profile status in rats with streptozotocin diabetes. Clinical and Experimental Pharmacology and Physiology. 2006; 33(3):232-7. [DOI:10.1111/j.1440-1681.2006.04351.x] [PMID]
17.Proks P, Reimann F, Green N, Gribble F, Ashcroft F. Sulfonylurea stimulation of insulin secretion. Diabetes. 2002; 51 Suppl 3:S368-76. [DOI:10.2337/diabetes.51.2007.S368] [PMID]
18.Kedar P, Chakrabarti CH. Effects of bittergourd (Momordica charantia) seed & glibenclamide in streptozotocin induced diabetes mellitus. Indian Journal of Experimental Biology. 1982; 20(3):232-5. [PMID]
19.Chaudhry ZR, Chaudhry SR, Naseer A, Chaudhry FR. Effect of Syzygium aromaticum (clove) extract on blood glucose level in streptozotocin induced diabetic rats. Pakistan Armed Forces Medical Journal. 2013; 63(3):323-8. https://inis.iaea.org/search/searchsinglerecord.aspx?recordsFor=SingleRecord&RN=45041146
20.Yadav UCS, Moorthy K, Baquer NZ. Effects of sodium-orthovanadate and Trigonella foenum-graecum seeds on hepatic and renal lipogenic enzymes and lipid profile during alloxan diabetes. Journal of Biosciences. 2004; 29(1):81-91. [DOI:10.1007/BF02702565] [PMID]
21.Mitra SK, Gopumadhavan S, Muralidhar TS, Anturlikar SD, Sujatha MB. Effect of D-400, a herbomineral preparation on lipid profile, glycated haemoglobin and glucose tolerance in streptozotocin induced diabetes in rats. Indian Journal of Experimental Biology. 1995; 33(10):798-800. [PMID]
22.al-Shamaony L, al-Khazraji SM, Twaij HA. Hypoglycaemic effect of Artemisia herba alba. II. Effect of a valuable extract on some blood parameters in diabetic animals. Journal of Ethnopharmacology. 1994; 43(3):167-71. [DOI:10.1016/0378-8741(94)90038-8] [PMID]
23.Jung CH, Ahn J, Jeon TI, Kim TW, Ha TY. Syzygium aromaticum ethanol extract reduces highfat diet-induced obesity in mice through downregulation of adipogenic and lipogenic gene expression. Experimental and Therapeutic Medicine. 2012; 4(3):409-14. [DOI:10.3892/etm.2012.609] [PMID] [PMCID]
24.Shyamala MP, Venukumar MR, Latha MS. Antioxidant potential of the Syzygium aromaticum (Gaertn.) Linn.(cloves) in rats fed with high fat diet. Indian Journal of Pharmacology. 2003; 35(2):99-103. https://www.researchgate.net/publication/266091697
25.Alessio HM, Goldfarb AH. Lipid peroxidation and scavenger enzymes during exercise: Adaptive response to training. Journal of Applied Physiology. 1988; 64(4):1333-6. [DOI:10.1152/jappl.1988.64.4.1333] [PMID]
26.Fujiwara Y, Kondo T, Murakami K, Kawakami Y. Decrease of the inhibition of lipid peroxidation by glutathione-dependent system in erythrocytes of non-insulin dependent diabetics. Klinische Wochenschrift. 1989; 67(6):336-41. [DOI:10.1007/BF01741388] [PMID]
27.Blokhina O, Virolainen E, Fagerstedt KV. Antioxidants, oxidative damage and oxygen deprivation stress: A review. Annals of Botany. 2003; 91 Spec No(2):179-94. [DOI:10.1093/aob/mcf118] [PMID] [PMCID]
28.Masella R, Di Benedetto R, Varì R, Filesi C, Giovannini C. Novel mechanisms of natural antioxidant compounds in biological systems: Involvement of glutathione and glutathione-related enzymes. The Journal of Nutritional Biochemistry. 2005; 16(10):577-86. [DOI:10.1016/j.jnutbio.2005.05.013] [PMID]
29.Yadav AS, Bhatnagar D. Modulatory effect of spice extracts on iron-induced lipid peroxidation in rat liver. Biofactors. 2007; 29(2-3):147-57. [DOI:10.1002/biof.552029205] [PMID]
30.Halliwell B. Superoxide-dependent formation of hydroxyl radicals in the presence of iron chelates: Is it a mechanism for hydroxyl radical production in biochemical systems? FEBS Letters. 1978; 92(2):321-6. [DOI:10.1016/0014-5793(78)80779-0] [PMID]
31.Nassar MI, Gaara AH, El-Ghorab AH, Farrag ARH. Chemical constituents of clove (Syzygium aromaticum, Fam. Myrtaceae) and their antioxidant activity. Revista Latinoamericana de Quimica. 2007; 35(3):47-57. https://www.researchgate.net/publication/228357516
32.Pulikottil SJ, Nath S. Potential of clove of Syzygium aromaticum in development of a therapeutic agent for periodontal disease: A review. South African Dental Journal. 2015; 70(3):108-15. http://www.scielo.org.za/scielo.php?script=sci_arttext&pid=S0011-85162015000300010
33.Van Acker ASBE, Van Den Berg DJ, Tromp MNJL, Griffioen DH, Van Bennekom WP, Van Der Vijgh WJF, et al. Structural aspects of antioxidant activity of flavonoids. Free Radical Biology and Medicine. 1996; 20(3):331-42. [DOI:10.1016/0891-5849(95)02047-0]
34.Shukri R, Mohamed S, Mustapha NM. Cloves protect the heart, liver and lens of diabetic rats. Food Chemistry. 2010; 122(4):1116-21. [DOI:10.1016/j.foodchem.2010.03.094]
35.Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans: Role of oxidative stress. Circulation. 2002; 106(16):2067-72. [DOI:10.1161/01.CIR.0000034509.14906.AE] [PMID]
36.Ozdemır G, Ozden M, Maral H, Kuskay S, Cetinalp P, Tarkun I. Malondialdehyde, glutathione, glutathione peroxidase and homocysteine levels in type 2 diabetic patients with and without microalbuminuria. Annals of Clinical Biochemistry. 2005; 42(Pt 2):99-104. [DOI:10.1258/0004563053492838] [PMID]
37.Navarro VJ, Senior JR. Drug-related hepatotoxicity. New England Journal of Medicine. 2006; 354(7):731-9. [DOI:10.1056/NEJMra052270] [PMID]
38.Golub EE, Boesze-Battaglia K. The role of alkaline phosphatase in mineralization. Current Opinion in Orthopaedics. 2007; 18(5):444-8. [DOI:10.1097/BCO.0b013e3282630851]
39.Vozarova B, Stefan N, Lindsay RS, Saremi A, Pratley RE, Bogardus C, et al. High alanine aminotransferase is associated with decreased hepatic insulin sensitivity and predicts the development of type 2 diabetes. Diabetes. 2002; 51(6):1889-95. [DOI:10.2337/diabetes.51.6.1889] [PMID]
40.Hanley AJ, Williams K, Festa A, Wagenknecht LE, D’Agostino RB Jr, Kempf j, et al. Elevations in markers of liver injury and risk of type 2 diabetes: The insulin resistance atherosclerosis study. Diabetes. 2004; 53(10):2623-32. [DOI:10.2337/diabetes.53.10.2623] [PMID]
41.Nyblom H, Berggren U, Balldin J, Olsson R. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking. Alcohol and Alcoholism. 2004; 39(4):336-9. [DOI:10.1093/alcalc/agh074] [PMID]
42.Gülçin I, Elmastaş M, Aboul-Enein HY. Antioxidant activity of clove oil-A powerful antioxidant source. Arabian Journal of Chemistry. 2012; 5(4):489-99. [DOI:10.1016/j.arabjc.2010.09.016]
43.Sadeek EA, El-Razek FHA. The chemo-protective effect of turmeric, chili, cloves and cardamom on correcting iron overload-induced liver injury, oxidative stress and serum lipid profile in rat models. Journal of American Science. 2010; 6(10):702-12. http://www.jofamericanscience.org/journals/am-sci/am0610/82_3676am0610_702_712.pdf
نوع مطالعه: پژوهشی |
موضوع مقاله:
پزشكي آزمايشگاهی
دریافت: 1399/2/28 | پذیرش: 1399/5/27 | انتشار: 1399/7/10
دریافت: 1399/2/28 | پذیرش: 1399/5/27 | انتشار: 1399/7/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



.jpg)
.jpg)