دوره 28، شماره 3 - ( تابستان 1401 )
جلد 28 شماره 3 صفحات 411-398 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sadeghi Fazel F, Rashid Lamir A, Khajeie R, Safipour Afshar A. The Effect of Combined Training on ABCG5 and ABCG8 in Coronary Artery Bypass Graft Patients. Intern Med Today 2022; 28 (3) :398-411
URL: http://imtj.gmu.ac.ir/article-1-3858-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3858-fa.html
صادقی فاضل فریدا، رشید لمیر امیر، خواجهای رامبد، صفیپور افشار اکبر. بررسی تأثیر آموزش ترکیبی بر روی ژنهای ABCG5 و ABCG8 در بیماران عمل قلب باز. طب داخلی روز. 1401; 28 (3) :398-411
1- گروه فیزیولوژی ورزشی، دانشکده علوم انسانی، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی، مشهد، ایران.
3- گروه فیزیولوژی ورزشی، دانشکده علوم انسانی، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران. ،RambodKhajeie@gmail.com
4- گروه زیست شناسی، دانشکده علوم، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران.
2- گروه فیزیولوژی ورزشی، دانشکده علوم ورزشی، دانشگاه فردوسی، مشهد، ایران.
3- گروه فیزیولوژی ورزشی، دانشکده علوم انسانی، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران. ،
4- گروه زیست شناسی، دانشکده علوم، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران.
متن کامل [PDF 3768 kb]
(909 دریافت)
| چکیده (HTML) (2727 مشاهده)
References
1.Nazari N, Hashemi-Javaheri AA, Rashid-Lami A, Alaviniya E. Effect of cardiac rehabilitation on strength and balance in patients after coronary artery bypass graft. Zahedan Journal of Research in Medical Sciences. 2013; 16(1):74-8. [Link]
2.Oram JF. HDL apolipoproteins and ABCA1: partners in the removal of excess cellular cholesterol. Arteriosclerosis, thrombosis, and Vascular Biology. 2003; 23(5):720-7. [DOI:10.1161/01.ATV.0000054662.44688.9A]
3.Askari B, Rashidlamir A, Askari A, Habibian M, Saadatniya A. Effect of eight weeks of cardiac rehabilitation training on PPAR-α gene expression in CABG patients. Medical Laboratory Journal. 2018; 12(2):27-31. [DOI:10.29252/mlj.12.2.27]
4.Hattori H, Kujiraoka T, Egashira T, Saito E, Fujioka T, Takahashi S, et al. Association of coronary heart disease with pre-β-HDL concentrations in Japanese men. Clinical Chemistry. 2004; 50(3):589-95. [DOI:10.1373/clinchem.2003.029207]
5.Justice JE. Management of cholesterol in the diabetic patient [MSc, thesis]. United States: Northern Kentucky University; 2004. [Link]
6.Yeboah J. more-intensive vs less-intensive LDL-cholesterol lowering reduces mortality. Annals of internal medicine. 2018; 169(2):JC6.[DOI:10.7326/ACPJC-2018-169-2-006]
7.Axmann M, Strobl WM, Plochberger B, Stangl H. Cholesterol transfer at the plasma membrane. Atherosclerosis. 2019; 290:111-7. [DOI:10.1016/j.atherosclerosis.2019.09.022]
8.Rashidlamir A, Saadatnia A, Ebrahimi-Atri A, Delphan M. Effect of eight weeks of wrestling and circuit fitness training on APO lipoprotein AI and lymphocyte ABCA1 gene expression in well-trained wrestlers. International Journal of Wrestling Science. 2011; 1(2):48-53. [DOI:10.1080/21615667.2011.10878931]
9.Yu XH, Qian K, Jiang N, Zheng XL, Cayabyab FS, Tang CK. ABCG5/ABCG8 in cholesterol excretion and atherosclerosis. Clinica Chimica Acta. 2014; 428:82-8. [DOI:10.1016/j.cca.2013.11.010]
10.Lee JY, Kinch LN, Borek DM, Wang J, Wang J, Urbatsch IL, et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 2016; 533(7604):561-4. [DOI:10.1038/nature17666]
11.Zein AA, Kaur R, Hussein TO, Graf GA, Lee JY. ABCG5/G8: A structural view to pathophysiology of the hepatobiliary cholesterol secretion. Biochemical Society Transactions. 2019; 47(5):1259-68. [DOI:10.1042/BST20190130]
12.Tada H, Okada H, Nomura A, Takamura M, Kawashiri MA. Beneficial effect of ezetimibe-atorvastatin combination therapy in patients with a mutation in ABCG5 or ABCG8 gene. Lipids in Health and Disease. 2020; 19(1):3.[DOI:10.1016/S0735-1097(19)32342-3]
13.Neumann J, Rose-Sperling D, Hellmich UA. Diverse relations between ABC transporters and lipids: An overview. Biochimica et Biophysica Acta. Biomembranes. 2017; 1859(4):605-18.[DOI:10.1016/j.bbamem.2016.09.023]
14.Tiainen S, Kiviniemi A, Hautala A, Huikuri H, Ukkola O, Tokola K, et al. Effects of a two-year home-based exercise training program on oxidized LDL and HDL lipids in coronary artery disease patients with and without type-2 diabetes. Antioxidants. 2018; 7(10):144. [DOI:10.3390/antiox7100144]
15.Ahn N, Kim K. High-density lipoprotein cholesterol (HDL-C) in cardiovascular disease: Effect of exercise training. Integrative Medicine Research. 2016; 5(3):212-5. [DOI:10.1016/j.imr.2016.07.001]
16.Ruiz-Ramie JJ, Barber JL, Sarzynski MA. Effects of exercise on HDL functionality. Current opinion in lipidology. 2019; 30(1):16-23. [DOI:10.1097/MOL.0000000000000568]
17.Miozzo AP, Stein C, Marcolino MZ, Sisto IR, Hauck M, Coronel CC, et al. Effects of high-intensity inspiratory muscle training associated with aerobic exercise in patients undergoing CABG: randomized clinical trial. Brazilian journal of Cardiovascular Surgery. 2018; 33(4):376-83. [DOI:10.21470/1678-9741-2018-0053]
18.Ghanbari-Niaki A, Rahmati-Ahmadabad S, Zare-Kookandeh N. ABCG8 gene responses to 8 weeks treadmill running with or without Pistachia atlantica (Baneh) extraction in female rats. International journal of endocrinology and metabolism. 2012; 10(4):604-10. [DOI:10.5812/ijem.5305]
19.Wang J, Mitsche MA, Lütjohann D, Cohen JC, Xie XS, Hobbs HH. Relative roles of ABCG5/ABCG8 in liver and intestine. Journal of lipid research. 2015; 56(2):319-30. [DOI:10.1194/jlr.M054544]
20.LeCheminant JD, Tucker LA, Bailey BW, Peterson T. The relationship between intensity of physical activity and HDL cholesterol in 272 women. Journal of Physical Activity and Health. 2005; 2(3):333-44. [DOI:10.1123/jpah.2.3.333]
21.Elmer DJ, Laird RH, Barberio MD, Pascoe DD. Inflammatory, lipid, and body composition responses to interval training or moderate aerobic training. European journal of applied physiology. 2016; 116(3):601-9.[DOI:10.1007/s00421-015-3308-4]
22.Glenney SS, Brockemer DP, Ng AC, Smolewski MA, Smolgovskiy VM, Lepley AS. Effect of exercise training on cardiac biomarkers in at-risk populations: a systematic review. Journal of Physical Activity and Health. 2017; 14(12):968-89. [DOI:10.1123/jpah.2016-0631]
23.Kodama S, Tanaka S, Saito K, Shu M, Sone Y, Onitake F, et al. Effect of aerobic exercise training on serum levels of high-density lipoprotein cholesterol: A meta-analysis. Archives of internal medicine. 2007; 167(10):999-1008. [DOI:10.1001/archinte.167.10.999]
24.Rashidlamir A, Dastani M, Saadatnia A, Bassami MR. Effect of cardiac rehabilitation training on ABCA1 expression in lymphocytes of patients undergoing coronary artery bypass graft operation. Zahedan Journal of Research in Medical Sciences. 2018; 20(6):e11277. [DOI:10.5812/zjrms.11277]
25.Benjamin EJ, Virani SS, Callaway CW, Chamberlain AM, Chang AR, Cheng S, et al. Heart disease and stroke statistics-2018 update: a report from the American Heart Association. Circulation. 2018; 137(12):e67-492. [DOI:10.1161/CIR.0000000000000573]
26.Rashidlamir A. [Investigation of the effect of aerobic and resistance exercises on peripheral blood mononuclear cells ABCG1 gene expression in female athletes (Persian)]. Journal of Shahid Sadoughi University of Medical Sciences. 2012; 20(1):1-9. [Link]
27.Rahmati-Ahmadabad S, Broom DR, Ghanbari-Niaki A, Shirvani H. Effects of exercise on reverse cholesterol transport: A systemized narrative review of animal studies. Life Sciences. 2019; 224:139-48. [DOI:10.1016/j.lfs.2019.03.058] [PMID]
28.Ma Z, Deng C, Hu W, Zhou J, Fan C, Di S, et al. Liver X receptors and their agonists: targeting for cholesterol homeostasis and cardiovascular diseases. Current issues in molecular biology. 2017; 22:41-64. [DOI:10.21775/cimb.022.041] [PMID]
29.Patel SB, Graf GA, Temel RE. Thematic review series: Lipid transfer proteins ABCG5 and ABCG8: more than a defense against xenosterols. Journal of lipid research. 2018; 59(7):1103-13. [DOI:10.1194/jlr.R084244]
30.Wilund KR, Feeney LA, Tomayko EJ, Weiss EP, Hagberg JM. Effects of endurance exercise training on markers of cholesterol absorption and synthesis. Physiological research. 2009; 58(4):545-52. [DOI:10.33549/physiolres.931515]
31.Ngo Sock ET, Farahnak Z, Lavoie JM. Exercise training decreases gene expression of endo-and xeno-sensors in rat small intestine. Applied Physiology, Nutrition, and Metabolism. 2014; 39(10):1098-103.[DOI:10.1139/apnm-2013-0573]
32.Rocco DD, Okuda LS, Pinto RS, Ferreira FD, Kubo SK, Nakandakare ER, et al. Aerobic exercise improves reverse cholesterol transport in cholesteryl ester transfer protein transgenic mice. Lipids. 2011; 46(7):617-25. [DOI:10.1007/s11745-011-3555-z] [PMID]
33.Marinangeli CP, Varady KA, Jones PJ. Plant sterols combined with exercise for the treatment of hypercholesterolemia: overview of independent and synergistic mechanisms of action. The Journal of nutritional biochemistry. 2006; 17(4):217-24.[DOI:10.1016/j.jnutbio.2005.09.003]
34.Rashidlamir A, Ghanbari-Niaki A, Saadatnia A. The Effect of eight weeks of wrestling and wrestling technique based circuit training on lymphocyte ABCA1 gene expression and plasma apolipoprotein AI. World Journal of Sport Sciences. 2011; 4(2):144-50. [Link]
35.Degirolamo C, Sabba C, Moschetta A. Intestinal nuclear receptors in HDL cholesterol metabolism. Journal of Lipid Research. 2015; 56(7):1262-70. [DOI:10.1194/jlr.R052704] [PMCID]
36.Wang HH, Garruti G, Liu M, Portincasa P, Wang DQ. Cholesterol and lipoprotein metabolism and atherosclerosis: recent advances in reverse cholesterol transport. Annals of Hepatology. 2017; 16(S 1):S27-42.[DOI:10.5604/01.3001.0010.5495]
37.Divine JK, Staloch LJ, Haveri H, Jacobsen CM, Wilson DB, Heikinheimo M, et al. GATA-4, GATA-5, and GATA-6 activate the rat liver fatty acid binding protein gene in concert with HNF-1α. American Journal of Physiology. Gastrointestinal and Liver Physiology. 2004; 287(5):G1086-99. [DOI:10.1152/ajpgi.00421.2003]
38.Broderick TL, Parrott CR, Wang D, Jankowski M, Gutkowska J. Expression of cardiac GATA4 and downstream genes after exercise training in the db/db mouse. Pathophysiology. 2012; 19(3):193-203. [DOI:10.1016/j.pathophys.2012.06.001]
39.Xiao J, Xu T, Li J, Lv D, Chen P, Zhou Q, et al. Exercise-induced physiological hypertrophy initiates activation of cardiac progenitor cells. International journal of Clinical and Experimental Pathology. 2014; 7(2):663-9. [PMID]
40.Broderick TL, Wang D, Jankowski M, Gutkowska J. Unexpected effects of voluntary exercise training on natriuretic peptide and receptor mRNA expression in the ob/ob mouse heart. Regulatory peptides. 2014; 188:52-9.[DOI:10.1016/j.regpep.2013.12.005]
41.Jafari M. [Effect of physical activity on prevention and treatment of atherosclerosis: focus on activity of ABCG5 and ABCG8 genes (Persian)]. Journal of Gorgan University of Medical Sciences. 2019; 21(3):13-23. [Link]
42.Côté I, Ngo Sock ET, Lévy É, Lavoie JM. An atherogenic diet decreases liver FXR gene expression and causes severe hepatic steatosis and hepatic cholesterol accumulation: effect of endurance training. European journal of nutrition. 2013; 52(5):1523-32. [DOI:10.1007/s00394-012-0459-5]
43.Ghanbari-Niaki A, Kookandeh NZ, Kookandeh AZ. ABCG5 gene responses to treadmill running with or without administration of Pistachio atlantica in female rats. Iranian Journal of Basic Medical Sciences. 2014; 17(3):162-71. [doi:10.22038/ijbms.2014.2401]
44.Hosseini Sm, Darrudi S, Talebi K, Rashidlamir A. [Effect of hit and aerobic exercises on ABCG4, ABCG5 and ABCG8 gene expression female athletes (Persian)]. International Sports Science Conference. 2017; (4). [Link]
45.Taylor RS, Brown A, Ebrahim S, Jolliffe J, Noorani H, Rees K, et al. Exercise-based rehabilitation for patients with coronary heart disease: Systematic review and meta-analysis of randomized controlled trials. The American Journal of Medicine. 2004; 116(10):682-92. [DOI:10.1016/j.amjmed.2004.01.009]
متن کامل: (1430 مشاهده)
مقدمه
در کنار یک سبک زندگی کمتحرک، زندگی مدرن مملو از عوامل تشدید مشکلات سلامت ازجمله بیماریهای قلبیعروقی است. بررسیهای شیوعی براساس عواملی چون تغذیه، سبک زندگی و ورزش نشان میدهد که افزایش بیماریهای قلبیعروقی عمدتاً با کاهش فعالیت فیزیکی و عادات غذایی ناسالم مانند مصرف مواد غذایی چرب و فرآوریشده مرتبط است [1]. بیماریهای قلبیعروقی که اغلب با پیشینه تنگی عروق کرونری (آترواسکلروز) آغاز میشوند از عوامل اصلی مرگومیر و ناتوانی در بسیاری از کشورها مانند ایران است. سهم بالای موادی چون کلسترول در ایجاد بیماریهای کرونری بهعنوان مهمترین عامل مرتبط با بیماریهای قلبی شناخته شده است [2].
علیرغم مفید بودن کلسترول در حفظ چندین فرآیند مهم سلولی، بیشتولید آن میتواند عملکرد سلولی را به خطر بیاندازد [3]. در بدن انسان، حدود دو سوم کلسترول ازطریق لیپوپروتئینهای با چگالی پایین، حدود 20 درصد آن توسط لیپوپرتئینهای با چگالی بالا و 14 درصد دیگر ازطریق لیپوپروتئینهای با چگالی بسیار پایین جابهجا میشود [3]. زمانی که سطوح کلسترولهای سلولی از سطوح فسفولیپیدهای موجود در غشا تجاوز میکند یا زمانی که کلسترول به کلسترول استر تبدیل میشود، کلسترولهای اضافی در سلول سم ایجاد میکند [2]. تاکنون مکانیزمهای متعددی درخصوص سمی بودن کلسترول معرفی شده است که شامل کریستالهای کلسترول، تراکم مسیر آپوپتوز، تشکیل اکسیسترول سمی و ناهماهنگیهای کلسترولی میباشند که برای عملکرد آنزیمهای خاص و مولکولهای سیگنالدهنده مهم هستند. باوجوداین، همانطورکه در سطور قبل گفته شد، حذف کلسترول از سلول برای جلوگیری از آثار مضر افزایش کلسترول در سلول ضروری است [4].
انتقال معکوس کلسترول از دیواره رگ منجر به اتصال آپولیپوپروتئین AI میشود تا لیپوپروتئینهای با چگالی بالا ایجاد کند؛ با این هدف که کلسترول را ازطریق پروتئینهای انتقال آدنوزین تریفسفات از محیط سلول حذف کند [5]؛ این عمل به واسطه انتقالدهنده ABC میباشد [6]. انتقالدهندههای اصلی ترشح کلسترول صفرا ABCG5 و ABCG8 میباشند و کدهای آنها نزدیک به یکدیگر در کرموزوم 2p21 است که در آن مکان تغییر این ژنها یا عدم عملکرد این 2 پروتئین منجر به اختلال لیپیدی با نام سیتوسترلومی میشود. چنین اختلالاتی موجب تجمیع کلسترول میشود که درنهایت تنگی عروق کرونری را ایجاد میکند که میتواند سکتههای قلبی خفیف را به همراه داشته باشد [7, 8]. بااینحال، این 2 پروتئین استرولهای گیاهی و کلسترول از انتروسیتها به دستگاههای روده ترشح میکنند و آنها را از سلولهای کبدی در صفرا دفع میکند؛ از این طریق منجر به کاهش کلسترول اضافه از دیوارههای کرونری و کاهش سطوح کلسترول خون میشود؛ ازاینرو خطر گرفتگی عروق کرونری و سکتههای قلبی را کاهش میدهد [9]. بنابراین، ورزش بهعنوان روشی مقرون به صرفه و مؤثر در کاهش کلسترول و متعاقباً درمان گرفتگی عروق کرونری درنظر گرفته میشود [2].
مطالعات اخیر نشان داده است که فعالیت فیزیکی میتواند موجب بهبود مراحل انتقال معکوس کلسترول شود، ازجمله بهبود در میزان لیپوپرتئینهای با چگالی بالا ازطریق افزایش فعالیت آنزیم لسیتین-کلسترول اسیلترانسفراز و بازگشت کلسترول از سلولها ازطریق فعالیت پروتئین ABC [10, 11, 12, 13, 14]. این مکانیزمها بیان میکنند که فعالیت فیزیکی یک راهکار بالقوه برای بیماران دچار گرفتگی عروق کرونری میباشد که پس از عمل قلب باز پیشنهاد میشود [15]. باتوجهبه این امر که فعالیت فیزیکی مداوم با شدت پایین تا متوسط خطر بیماریهای قلبی کرونری را کاهش میدهد [16, 17]. مطالعات متعددی به نقش ورزش در کاهش چشمگیر سطوح لیپید خون، کاهش لیپوپروتئینهای با چگالی پایین و لیپوپروتئینهای با چگالی بسیار پایین و متعاقباً افزایش لیپوپروتئینهای با چگالی بالا و بهبود شرایط سلامت این دسته از بیماران پرداختهاند [13, 18, 19, 20, 21]. بنابراین، باتوجهبه تأثیر ورزش بر سطوح کلسترول که با کاهش خطر عوامل بیماریهای قلبی و عروقی مرتبط است. همچنین نتایج گزارشهای بینتیجه درباره بیان ژنهای ABCG5 و ABCG8، این مطالعه درصدد است تا تأثیر 8 هفته تمرین هوازی مقاومتی را در بیان مجموعهای از ژنهای خاص در بیماران عمل قلب باز بررسی کند.
مواد و روشها
این یک مطالعه شبهتجربی همراه با یک گروه کنترل بود. همچنین، این تحقیق پایبند بر تمامی دستورالعملهای معرفیشده در بیانیه هلسینکی و مطابق بر اصول اخلاقی مرتبط با آزمایشهای انسانی میباشد. همه افراد حاضر در مطالعه از مزایا و معایب پروتوکلهای حین مطالعه مطلع شدند. بهطورکلی، 30 مرد ازطریق روش نمونهگیری دردسترس در بخش توانبخشی بیمارستان قلب جوادالائمه انتخاب شدند. همه افراد انتخابشده در 1 سال گذشته عمل جراحی قلب بایپس انجام داده بودند. در مطالعه حاضر از ضوابط ورود و خروج که به شرح ذیل آمده است، استفاده شد تا گروههای مورد تحلیل یکدست شوند.
ضوابط ورود و خروج
سلامت فردی ادراکی، بینایی و شنوایی؛ نبودن فشارخون بالاتر از 160 میلیتر جیوه و فشار خون دیاستولیک بالاتر از 100 میلیلیتر جیوه؛ عدم استفاده از داروهای مشابه؛ و عدماستفاده از وسیلههای کمک حرکتی مانند واکر. بنابراین، 30 مرد با شرایط عمل قلب باز (شاخص توده بدن=25/11±1/57 کیلوگرم بر مترمربع؛ سن=6/90±55/37 سال؛ وزن=5/87±75/45 کیلوگرم) انتخاب شدند تا در مطالعه حاضر شرکت کنند. بهصورت تصادفی، 15 مرد در گروه آزمایش قرار گرفتند (شاخص توده بدن =24/94±1/8؛ سن=6/47 ±54/58 سال؛ وزن=6/6±74/75 کیلوگرم) و مداخله ورزشی دریافت کردند؛ درحالیکه 15 نفر دیگر بهصورت تصادفی در گروه کنترل قرار گرفتند و هیچ نوع مداخلهای دریافت نکردند (=25/28±1/3شاخص توده بدنی کیلوگرم بر مترمربع؛ سن=7/5±56/16 سال؛ وزن=5/23±76/16 کیلوگرم).
طراحی آزمایش
تمرین هوازی
قواعد تمرین هوازی بهصورت 3 روز در هفته با درنظر گرفتن 24 ساعت فاصله زمانی بین هر جلسه تمرین که مجموعاً 24 جلسه تمرینی در طول مطالعه بود. هر جلسه تمرینی بهصورت انفرادی برگزار شد. باتوجهبه وضعیت شرایط قلبیریوی و تحمل فیزیکی هر فرد، 42 دقیقه زمان انجام هر جلسه بود. جلسات تمرینی شامل پیادهروی بر روی تردمیل (20 تا 30 دقیقه)، دوچرخه ثابت (10 تا 12 دقیقه) و استفاده از ارگومتر (10 دقیقه) بود. پیش از آغاز جلسه تمرینی، ورزشهای کششی جهت گرم کردن انجام میشد. همان تمرینات کششی جهت سردکردن پس از تمرینات مورد استفاده قرار میگرفت. شدت تمرین معادل 55 درصد حداکثر ضربان قلب بیماران بود که بهعنوان ضربان قلب هدف حین مراحل اولیه تمرین مشخص شد؛ سپس بهصورت تدریجی با درنظر گرفتن قابلیت بیمار تا 75 درصد حداکثر ضربان قلب بیماران در جلسات 7 تا 10 افزایش مییافت.
تمرینات مقاومتی
تمرینات مقاومتی 3 مرتبه در هفته در طول 8 هفته بهصورت یک در میان با تمرینات هوازی انجام شد. جلسات اولیه شامل 3 ست با 8 تکرار بود و تا 15 تکرار در جلسات بعدی افزایش مییافت. جلسات تمرینات مقاومتی شامل انجام حرکت اسکات با فیزیوبال، تمرین انقباض کول، تمرین انقباض باسن، انبساط کول، انبساط باسن، انقباض آرنج، پلانتار مچ پا و انقباض دورسی مچ پا بود. این حرکات ابتدا با 8 تکرار به کمک تراباند سبک (زرد) انجام شد. سپس، 2 تکرار به هر حرکت در هر جلسه افزوده شد تا تعداد کل تکرارها به 15 برسد. سپس، قدرت تراباند افزایش یافت (صورتی) و حرکات بهصورت تدریجی از 8 تکرار به 15 تکرار در جلسات بعد رسیدند. هر جلسه با 5 تا 10 دقیقه تمرینات کششی جهت گرم کردن و سرد کردن همراه بود. نوسان ضربان قلب بیمار توسط دستگاه مانیتور بررسی میشد.
ابزارها و فرآیندها
اجزای پیکرسنجی (آنتروپومتری)
در حضور اول در آزمایشگاه، وزن و درصد چربی شرکتکنندگان توسط دستگاه دیجیتال Inbody 720®، ساختهشده در کره جنوبی اندازهگیری شد. همچنین، قد شرکتکنندگان توسط دستگاه اندازهگیری قد دیجیتال سکا (سانتیمتر) ساختهشده در آلمان اندازهگیری شد. ضریب شاخص توده بدنی نیز بهعنوان وزن به کیلوگرم تقسیم بر مربع قد به متر اندازهگیری شد.
معیارهای قلبی
ضربان قلب ازطریق Polar® F1tm پولارمتر اندازهگیری شد و با فرمول کارونن در 3 موقعیت مختلف مورد ارزیابی قرار گرفت (در ابتدای جلسه تمرینی؛ در زمان سرد کردن؛ در انتهای جلسه تمرینی). افزایشهای 5 درصدی مطابق با ضربان قلب در هر هفته به ضربان قلب هدف اضافه شد، مادامی که شدت تمرینها افزایش مییافت [22, 23, 24]. فشارخون و همچنین فشار خون در استراحت ازطریق دستگاه ALPK-2-500 مورد ارزیابی قرار گرفت. این دادهها بعداً توسط پرستاران توانبخشی پس از هر جلسه تمرینی بررسی میشد.
تحلیل ژن
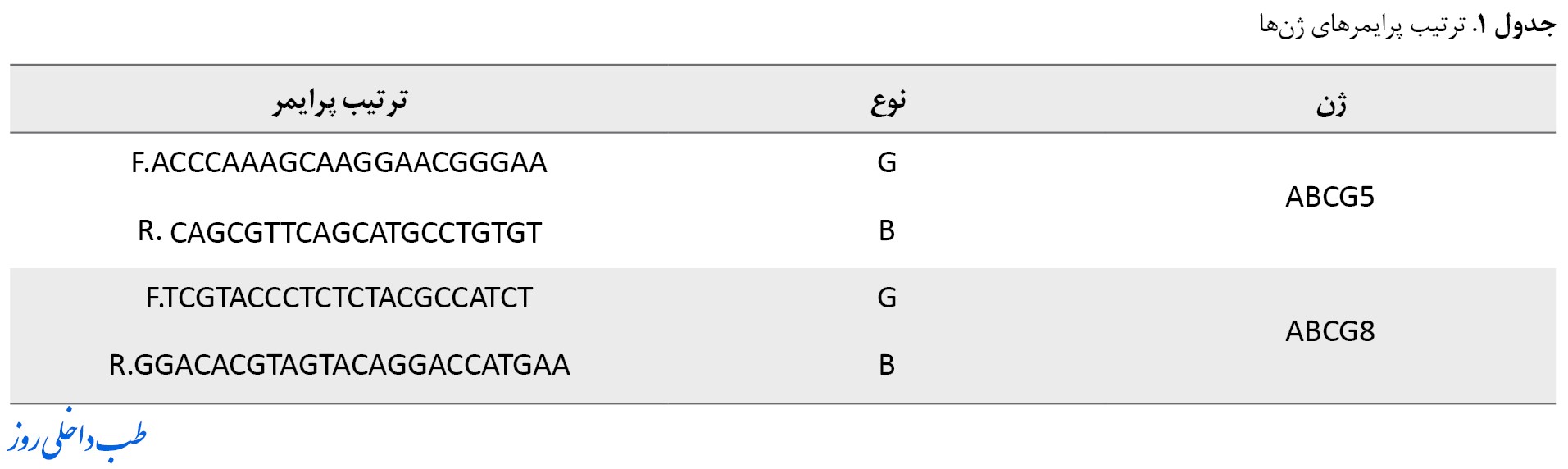
از شرکتکنندگان خواسته شد تا در حالت روزه 48 ساعت پیش از اولین تمرین و 48 ساعت پس از آخرین تمرین به آزمایشگاه مراجعه کنند. در زمان حضور، 10 میلیلیتر خون از آنها گرفته شد و جداسازی مونوسیت ازطریق پاکسازی mRNA Ficoll Monocyte صورت گرفت. نمونهها یکدست شدند تا از آنها mRNA در محلول بافر RLT گرفته شود و سپس با محدود نیتروژن (2 میلیلیتر) در لوله سانترفیوژ میکرو خالی از RNA ترکیب شوند. از تکنیک PCR آنی برای ارزیابی بیان نسبی ژنهای ABCG5/8 mRNA استفاده شد. ترتیب پرایمرهای استفادهشده برای اندازهگیری ژنهای ABCG 5 و ABCG 8 در جدول شماره 1 ارائه شده است.
تحلیل آماری
همه اندازهگیریها و تحلیلها بهصورت میانگین±انحرافمعیار گزارش شده و توسط نسخه 21 نرمافزار SPSS در سطح معناداری P≦0/05 به دست آمده است. پس از بررسی نرمال بودن توزیع دادهها ازطریق آزمون شاپیرو ویلک، یافتههای تحقیق ازطریق آزمون تی مستقل و آزمون تی جفتی مورد ارزیابی قرار گرفتند تا دادههای پیشآزمایش و پسآزمایش درونگروهی و برونگروهی مقایسه شوند.
یافتهها
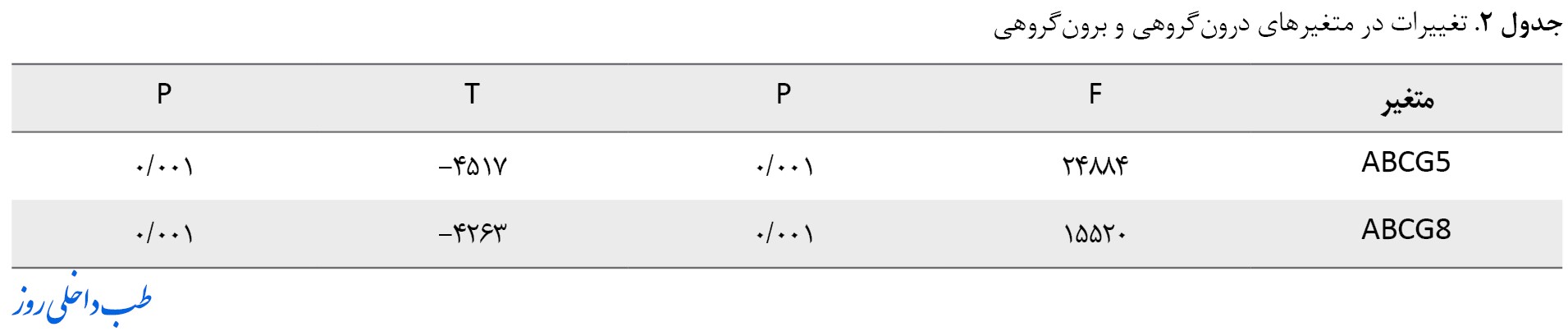
تکنیک PCR آنی مورد استفاده در این مطالعه نشان داد که تفاوت معناداری میان تمرین هوازی همراه با تمرینهای مقاومتی در گروه آزمایش نسبت به گروه کنترل در بیان ژنهای ABCG5 (P=0/001) و ABCG8 (P=0/001) وجود دارد. نتایج همبستگی آزمون تی همچنین نشان داد تفاوت معناداری میان نتایج پیش و پس از آزمون در گروه کنترل وجود دارد (t=-4/517; P=0/001) (جدول شماره 2).
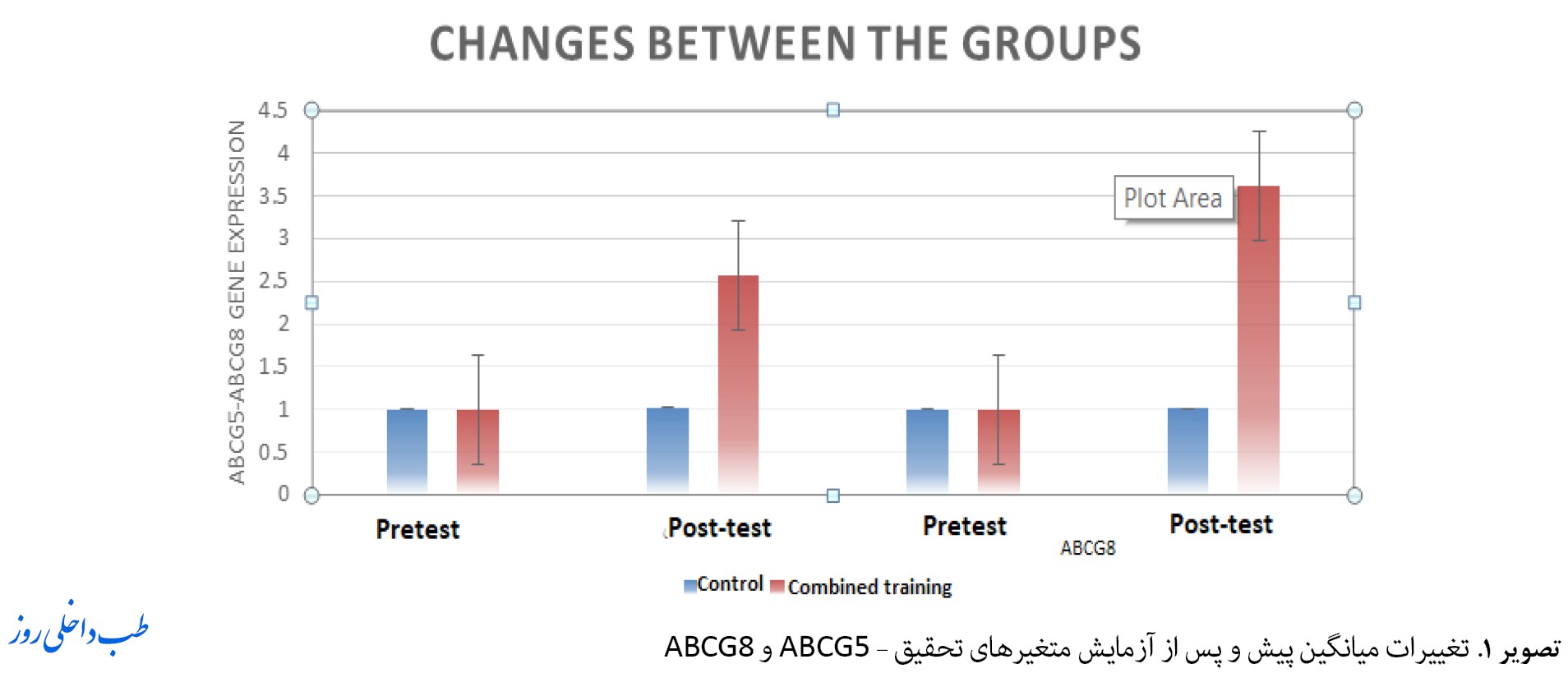
تصویر شماره 1 نشاندهنده تغییرات در بیان ژنهای ABCG5 و ABCG8 در گروه آزمایش در مقایسه با گروه کنترل را نشان میدهد که بیانگر یک افزایش چشمگیر است.
در کنار یک سبک زندگی کمتحرک، زندگی مدرن مملو از عوامل تشدید مشکلات سلامت ازجمله بیماریهای قلبیعروقی است. بررسیهای شیوعی براساس عواملی چون تغذیه، سبک زندگی و ورزش نشان میدهد که افزایش بیماریهای قلبیعروقی عمدتاً با کاهش فعالیت فیزیکی و عادات غذایی ناسالم مانند مصرف مواد غذایی چرب و فرآوریشده مرتبط است [1]. بیماریهای قلبیعروقی که اغلب با پیشینه تنگی عروق کرونری (آترواسکلروز) آغاز میشوند از عوامل اصلی مرگومیر و ناتوانی در بسیاری از کشورها مانند ایران است. سهم بالای موادی چون کلسترول در ایجاد بیماریهای کرونری بهعنوان مهمترین عامل مرتبط با بیماریهای قلبی شناخته شده است [2].
علیرغم مفید بودن کلسترول در حفظ چندین فرآیند مهم سلولی، بیشتولید آن میتواند عملکرد سلولی را به خطر بیاندازد [3]. در بدن انسان، حدود دو سوم کلسترول ازطریق لیپوپروتئینهای با چگالی پایین، حدود 20 درصد آن توسط لیپوپرتئینهای با چگالی بالا و 14 درصد دیگر ازطریق لیپوپروتئینهای با چگالی بسیار پایین جابهجا میشود [3]. زمانی که سطوح کلسترولهای سلولی از سطوح فسفولیپیدهای موجود در غشا تجاوز میکند یا زمانی که کلسترول به کلسترول استر تبدیل میشود، کلسترولهای اضافی در سلول سم ایجاد میکند [2]. تاکنون مکانیزمهای متعددی درخصوص سمی بودن کلسترول معرفی شده است که شامل کریستالهای کلسترول، تراکم مسیر آپوپتوز، تشکیل اکسیسترول سمی و ناهماهنگیهای کلسترولی میباشند که برای عملکرد آنزیمهای خاص و مولکولهای سیگنالدهنده مهم هستند. باوجوداین، همانطورکه در سطور قبل گفته شد، حذف کلسترول از سلول برای جلوگیری از آثار مضر افزایش کلسترول در سلول ضروری است [4].
انتقال معکوس کلسترول از دیواره رگ منجر به اتصال آپولیپوپروتئین AI میشود تا لیپوپروتئینهای با چگالی بالا ایجاد کند؛ با این هدف که کلسترول را ازطریق پروتئینهای انتقال آدنوزین تریفسفات از محیط سلول حذف کند [5]؛ این عمل به واسطه انتقالدهنده ABC میباشد [6]. انتقالدهندههای اصلی ترشح کلسترول صفرا ABCG5 و ABCG8 میباشند و کدهای آنها نزدیک به یکدیگر در کرموزوم 2p21 است که در آن مکان تغییر این ژنها یا عدم عملکرد این 2 پروتئین منجر به اختلال لیپیدی با نام سیتوسترلومی میشود. چنین اختلالاتی موجب تجمیع کلسترول میشود که درنهایت تنگی عروق کرونری را ایجاد میکند که میتواند سکتههای قلبی خفیف را به همراه داشته باشد [7, 8]. بااینحال، این 2 پروتئین استرولهای گیاهی و کلسترول از انتروسیتها به دستگاههای روده ترشح میکنند و آنها را از سلولهای کبدی در صفرا دفع میکند؛ از این طریق منجر به کاهش کلسترول اضافه از دیوارههای کرونری و کاهش سطوح کلسترول خون میشود؛ ازاینرو خطر گرفتگی عروق کرونری و سکتههای قلبی را کاهش میدهد [9]. بنابراین، ورزش بهعنوان روشی مقرون به صرفه و مؤثر در کاهش کلسترول و متعاقباً درمان گرفتگی عروق کرونری درنظر گرفته میشود [2].
مطالعات اخیر نشان داده است که فعالیت فیزیکی میتواند موجب بهبود مراحل انتقال معکوس کلسترول شود، ازجمله بهبود در میزان لیپوپرتئینهای با چگالی بالا ازطریق افزایش فعالیت آنزیم لسیتین-کلسترول اسیلترانسفراز و بازگشت کلسترول از سلولها ازطریق فعالیت پروتئین ABC [10, 11, 12, 13, 14]. این مکانیزمها بیان میکنند که فعالیت فیزیکی یک راهکار بالقوه برای بیماران دچار گرفتگی عروق کرونری میباشد که پس از عمل قلب باز پیشنهاد میشود [15]. باتوجهبه این امر که فعالیت فیزیکی مداوم با شدت پایین تا متوسط خطر بیماریهای قلبی کرونری را کاهش میدهد [16, 17]. مطالعات متعددی به نقش ورزش در کاهش چشمگیر سطوح لیپید خون، کاهش لیپوپروتئینهای با چگالی پایین و لیپوپروتئینهای با چگالی بسیار پایین و متعاقباً افزایش لیپوپروتئینهای با چگالی بالا و بهبود شرایط سلامت این دسته از بیماران پرداختهاند [13, 18, 19, 20, 21]. بنابراین، باتوجهبه تأثیر ورزش بر سطوح کلسترول که با کاهش خطر عوامل بیماریهای قلبی و عروقی مرتبط است. همچنین نتایج گزارشهای بینتیجه درباره بیان ژنهای ABCG5 و ABCG8، این مطالعه درصدد است تا تأثیر 8 هفته تمرین هوازی مقاومتی را در بیان مجموعهای از ژنهای خاص در بیماران عمل قلب باز بررسی کند.
مواد و روشها
این یک مطالعه شبهتجربی همراه با یک گروه کنترل بود. همچنین، این تحقیق پایبند بر تمامی دستورالعملهای معرفیشده در بیانیه هلسینکی و مطابق بر اصول اخلاقی مرتبط با آزمایشهای انسانی میباشد. همه افراد حاضر در مطالعه از مزایا و معایب پروتوکلهای حین مطالعه مطلع شدند. بهطورکلی، 30 مرد ازطریق روش نمونهگیری دردسترس در بخش توانبخشی بیمارستان قلب جوادالائمه انتخاب شدند. همه افراد انتخابشده در 1 سال گذشته عمل جراحی قلب بایپس انجام داده بودند. در مطالعه حاضر از ضوابط ورود و خروج که به شرح ذیل آمده است، استفاده شد تا گروههای مورد تحلیل یکدست شوند.
ضوابط ورود و خروج
سلامت فردی ادراکی، بینایی و شنوایی؛ نبودن فشارخون بالاتر از 160 میلیتر جیوه و فشار خون دیاستولیک بالاتر از 100 میلیلیتر جیوه؛ عدم استفاده از داروهای مشابه؛ و عدماستفاده از وسیلههای کمک حرکتی مانند واکر. بنابراین، 30 مرد با شرایط عمل قلب باز (شاخص توده بدن=25/11±1/57 کیلوگرم بر مترمربع؛ سن=6/90±55/37 سال؛ وزن=5/87±75/45 کیلوگرم) انتخاب شدند تا در مطالعه حاضر شرکت کنند. بهصورت تصادفی، 15 مرد در گروه آزمایش قرار گرفتند (شاخص توده بدن =24/94±1/8؛ سن=6/47 ±54/58 سال؛ وزن=6/6±74/75 کیلوگرم) و مداخله ورزشی دریافت کردند؛ درحالیکه 15 نفر دیگر بهصورت تصادفی در گروه کنترل قرار گرفتند و هیچ نوع مداخلهای دریافت نکردند (=25/28±1/3شاخص توده بدنی کیلوگرم بر مترمربع؛ سن=7/5±56/16 سال؛ وزن=5/23±76/16 کیلوگرم).
طراحی آزمایش
تمرین هوازی
قواعد تمرین هوازی بهصورت 3 روز در هفته با درنظر گرفتن 24 ساعت فاصله زمانی بین هر جلسه تمرین که مجموعاً 24 جلسه تمرینی در طول مطالعه بود. هر جلسه تمرینی بهصورت انفرادی برگزار شد. باتوجهبه وضعیت شرایط قلبیریوی و تحمل فیزیکی هر فرد، 42 دقیقه زمان انجام هر جلسه بود. جلسات تمرینی شامل پیادهروی بر روی تردمیل (20 تا 30 دقیقه)، دوچرخه ثابت (10 تا 12 دقیقه) و استفاده از ارگومتر (10 دقیقه) بود. پیش از آغاز جلسه تمرینی، ورزشهای کششی جهت گرم کردن انجام میشد. همان تمرینات کششی جهت سردکردن پس از تمرینات مورد استفاده قرار میگرفت. شدت تمرین معادل 55 درصد حداکثر ضربان قلب بیماران بود که بهعنوان ضربان قلب هدف حین مراحل اولیه تمرین مشخص شد؛ سپس بهصورت تدریجی با درنظر گرفتن قابلیت بیمار تا 75 درصد حداکثر ضربان قلب بیماران در جلسات 7 تا 10 افزایش مییافت.
تمرینات مقاومتی
تمرینات مقاومتی 3 مرتبه در هفته در طول 8 هفته بهصورت یک در میان با تمرینات هوازی انجام شد. جلسات اولیه شامل 3 ست با 8 تکرار بود و تا 15 تکرار در جلسات بعدی افزایش مییافت. جلسات تمرینات مقاومتی شامل انجام حرکت اسکات با فیزیوبال، تمرین انقباض کول، تمرین انقباض باسن، انبساط کول، انبساط باسن، انقباض آرنج، پلانتار مچ پا و انقباض دورسی مچ پا بود. این حرکات ابتدا با 8 تکرار به کمک تراباند سبک (زرد) انجام شد. سپس، 2 تکرار به هر حرکت در هر جلسه افزوده شد تا تعداد کل تکرارها به 15 برسد. سپس، قدرت تراباند افزایش یافت (صورتی) و حرکات بهصورت تدریجی از 8 تکرار به 15 تکرار در جلسات بعد رسیدند. هر جلسه با 5 تا 10 دقیقه تمرینات کششی جهت گرم کردن و سرد کردن همراه بود. نوسان ضربان قلب بیمار توسط دستگاه مانیتور بررسی میشد.
ابزارها و فرآیندها
اجزای پیکرسنجی (آنتروپومتری)
در حضور اول در آزمایشگاه، وزن و درصد چربی شرکتکنندگان توسط دستگاه دیجیتال Inbody 720®، ساختهشده در کره جنوبی اندازهگیری شد. همچنین، قد شرکتکنندگان توسط دستگاه اندازهگیری قد دیجیتال سکا (سانتیمتر) ساختهشده در آلمان اندازهگیری شد. ضریب شاخص توده بدنی نیز بهعنوان وزن به کیلوگرم تقسیم بر مربع قد به متر اندازهگیری شد.
معیارهای قلبی
ضربان قلب ازطریق Polar® F1tm پولارمتر اندازهگیری شد و با فرمول کارونن در 3 موقعیت مختلف مورد ارزیابی قرار گرفت (در ابتدای جلسه تمرینی؛ در زمان سرد کردن؛ در انتهای جلسه تمرینی). افزایشهای 5 درصدی مطابق با ضربان قلب در هر هفته به ضربان قلب هدف اضافه شد، مادامی که شدت تمرینها افزایش مییافت [22, 23, 24]. فشارخون و همچنین فشار خون در استراحت ازطریق دستگاه ALPK-2-500 مورد ارزیابی قرار گرفت. این دادهها بعداً توسط پرستاران توانبخشی پس از هر جلسه تمرینی بررسی میشد.
تحلیل ژن
از شرکتکنندگان خواسته شد تا در حالت روزه 48 ساعت پیش از اولین تمرین و 48 ساعت پس از آخرین تمرین به آزمایشگاه مراجعه کنند. در زمان حضور، 10 میلیلیتر خون از آنها گرفته شد و جداسازی مونوسیت ازطریق پاکسازی mRNA Ficoll Monocyte صورت گرفت. نمونهها یکدست شدند تا از آنها mRNA در محلول بافر RLT گرفته شود و سپس با محدود نیتروژن (2 میلیلیتر) در لوله سانترفیوژ میکرو خالی از RNA ترکیب شوند. از تکنیک PCR آنی برای ارزیابی بیان نسبی ژنهای ABCG5/8 mRNA استفاده شد. ترتیب پرایمرهای استفادهشده برای اندازهگیری ژنهای ABCG 5 و ABCG 8 در جدول شماره 1 ارائه شده است.

تحلیل آماری
همه اندازهگیریها و تحلیلها بهصورت میانگین±انحرافمعیار گزارش شده و توسط نسخه 21 نرمافزار SPSS در سطح معناداری P≦0/05 به دست آمده است. پس از بررسی نرمال بودن توزیع دادهها ازطریق آزمون شاپیرو ویلک، یافتههای تحقیق ازطریق آزمون تی مستقل و آزمون تی جفتی مورد ارزیابی قرار گرفتند تا دادههای پیشآزمایش و پسآزمایش درونگروهی و برونگروهی مقایسه شوند.
یافتهها
تکنیک PCR آنی مورد استفاده در این مطالعه نشان داد که تفاوت معناداری میان تمرین هوازی همراه با تمرینهای مقاومتی در گروه آزمایش نسبت به گروه کنترل در بیان ژنهای ABCG5 (P=0/001) و ABCG8 (P=0/001) وجود دارد. نتایج همبستگی آزمون تی همچنین نشان داد تفاوت معناداری میان نتایج پیش و پس از آزمون در گروه کنترل وجود دارد (t=-4/517; P=0/001) (جدول شماره 2).

تصویر شماره 1 نشاندهنده تغییرات در بیان ژنهای ABCG5 و ABCG8 در گروه آزمایش در مقایسه با گروه کنترل را نشان میدهد که بیانگر یک افزایش چشمگیر است.
بحث
مطالعه حاضر به بررسی تأثیر 8 هفته تمرین هوازی همراه با تمرینات مقاومتی در بیان ژنهای ABCG5 و ABCG8 در بیماران عمل قلب باز پرداخته است. مطالعه حاضر نشان داد 8 هفته تمرین هوازی همراه با تمرینات مقاومتی، بیان ژنهای ABCG5 و ABCG8 را در بیماران عمل قلب باز افزایش میدهد که میتواند منجر به کاهش بیماریهای قلبیعروقی شود.
یکی از خطرناکترین بیماریهای قلبی مربوط به بیماریهای عروق کرونری است که عمدتاً تحت عنوان موارد گرفتگی عروق کرونری معرفی میشوند. این نوع بیماری موجب کاهش خاصیت ارتجاعی دیواره رگها شده که دلیل آن تشکیل پلاکهای آتروسلروتیک و افزایش ضخامت عروق بهدلیل تجمیع کلسترول میباشد [22]. افزایش ناهنجاریهای اندوتلیال برخی انتقالدهندههای کلسترول در سطح غشای اندوتلیال در بیان و عملکرد سرکوب شده که منجر به افزایش بیماریهای قلبیعروقی میشود [23] و شامل کاهش بیان و عملکرد ناقص عوامل انتقال معکوس کلسترول با نام بسته پروتئینهای وابسته به ATP (ABC) میباشد؛ بهنحوی که این بیماران را در مقابل مداخلاتی که در جهت مرتبسازی رونوشت جهت افزایش انتقالدهنده کلسترول میباشد، مقاوم میسازد. بنابراین، مکانیزمهایی که انتقالدهندههای ABC را مختل میکند یا بر مسیرهای سلولی واقعی تأثیر میگذارند، میبایست مستقیماً درمان شوند [24].
خانواده ABC به ترتیبهای مختلفی تقسیم میشود که ABCG بزرگترین زیرمجموعه خانواده ABC است که انتقالدهنده مهم لیپید میباشد و دارای زیرخانوادههای متعددی ازجمله ABCG26, ABCG12, ABCG11, ABCG8, ABCG5, ABCG 4, ABCG3 ABCG2 و ABCG1 میباشد [25, 26 ,27, 28, 29 ,30]. تمامی این ABCG ها بهجز ABCG2 نقش مهمی در فرآیند انتقال معکوس کلسترول دارند. درواقع، 2 عضو خانواده انتقالدهنده ABC، یعنی ABCG5 و ABCG8 که هترودیمریک بوده و اغلب در کبد و روده کوچک بیان میشوند. جذب استرول را در روده محدود میکند و ترشح صفرایی را ازطریق کلسترولهای ایجادشده در کبد افزایش میدهد. انتقالدهندههای ABCG5 و ABCG8 ازطریق گیرندههای هپاتیک X کنترل میشوند [31, 32, 33, 34 ,35]. به بیان دیگر، LXR از طریق بیان بیش از حد ABCG5 و ABCG8 موجب ایجاد اسید صفرا می شود و کلسترول را در صفرا ترشح میکند که تقویتکننده دفع مدفوعی کلسترول درون رودهها میباشد [17, 36, 37, 38].
بیان بیش از اندازه انتقالدهندههای ژن ABCG5 و ABCG8 در موشها کلسترول غذایی را تا 50 درصد ازطریق افزایش ترشح صفرایی استرول کاهش میدهد. درعوض، ناهنجاریها در هر 2 ژن در موشها منجر به افزایش 3 برابری در جذب استرول در گیاهان غذایی شده که موجب افزایش سطوح سیتواسترول پلاسما تا 30 درصد به همراه کاهش سطوح کلسترول صفرایی میشود [26]. مزایای این انتقالدهندهها در هموستاز کلسترول آنها را اهداف درمانی مهم برای جلوگیری از بیماریهای گرفتگی قلبیعروقی بدل کرده است. باوجوداین، گرچه بسیاری از مطالعات نشان دادهاند که فعالیتهای ورزشی بیان انتقالدهندههای کلسترول را افزایش میدهند و بر سطوح کلسترول خون تأثیر میگذارند [29 ,30 ,31]، اما مهمترین بخش این مطالعات در راستای بررسی تأثیر فعالیتهای فیزیکی بر مکانیزمهای بیان ژنهای دخیل در فرآیند انتقال معکوس کلسترول میباشد که شامل خانواده انتقالدهنده ABC، بهویژه گونه G اغلب متمرکزشده در حیوانات میباشد که نشاندهنده شکاف دانشی درخصوص تأثیر این امر بر انسانها است [27، 28].
در این راستا، گروهی از محققین چنین گزارش کردهاند که سطح بیان ژن ABCG5 در موشهای ماده اسپراگوئه داولی پس از فعالیت هوازی با شدت متوسط بر روی تردمیل کاهش یافت (6 هفته دو افزایشی از 15 متر/دقیقه با صفر درصد شیب 15 دقیقه در روز (2 هفته) تا 60 دقیقه در روز با سرعت 26 متر در دقیقه با 10 درصد شیب (4 هفته) 5 مرتبه بهصورت هفتگی) [28]. بهعلاوه، مطالعات دیگر به بررسی تأثیر تمرین بر بیان ژن ABCG5 در بافت روده موشهای ماده پرداختند و یافتههای آنها نشان میدهد که بیان این ژن پس از تمرین (6 هفته دو افزایشی با سرعت 15 متر/دقیقه و شیب صفر درصد و 15 دقیقه در روز تا 60 دقیقه در روز با سرعت 26 متر در دقیقه و شیب 10 درصد، 5 بار در هفته) افزایش یافته است [39]. در مطالعه قنبری نیاکی و همکاران چنین گزارش میشود که بیان نسبی ژن ABCG5 چربی اطراف شکم پس از تمرین هوازی برروی تردمیل افزایش یافته است [40]. باوجوداین، حسینی و همکاران به بررسی تأثیر تمرینات هوازی و تمرینات با شدت بالا بر بیان ژنهای ABCG4, ABCG5 و ABCG8 در ماهیچه ورزشکاران پرداختند. نتایج آنها نشان داد که یک جلسه تمرین هوازی و تمرین با شدت بالا بیان ژنهای دخیل در انتقال کلسترول را در مقایسه با گروه کنترل تحریک کرده، اما هیچگونه تفاوت معناداری میان دو گروه آزمایشی دیده نشده است [41].
برنامههای توانبخشی بخش مهمی از فرآیند درمان در راستای بازگرداندن بیمار به شرایط فیزیکی، روانی و اجتماعی بهینه هستند [42]. درواقع، چنین نشان داده شده است که امید به زندگی پس از بهبود قلبی بهطرز چشمگیری افزایش مییابد که نشاندهنده مزایای این نوع استراتژیها میباشد. برنامههای تمرینی مرگومیر ناشی از بیماریهای قلبیعروقی را حدود 20 تا 25 درصد و مرگ بهدلیل بیماری قلبیعروقی را 22 تا 25 درصد 3 سال پس از بررسیهای ثانویه کاهش داده است. توانبخشی بهعنوان یک تسهیلگر در کنترل عوامل ریسک در این افراد میباشد. ازآنجاکه توانبخشی میتواند فرآیند بیماری را کند یا به تأخیر بیاندازد [42, 43, 44, 45].
براساس یافتههای تحقیق حاضر و در کنار دیگر مطالعات حیوانی، میتوان چنین بیان کرد که ترکیب تمرینهای هوازی و تمرینهای مقاومتی در بهبود انتقال معکوس کلسترول ازطریق بیان ژنهای ABCG5 و ABCG8 مؤثر است و بهعنوان درمانی پیشگیریکننده برای بیماران عمل قلب باز مطرح میباشد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با کد اخلاقی IR.IAU.NEYSHABUR.REC.1398.013 در دانشگاه آزاد اسلامی واحد نیشابور تأیید شده است.
حامی مالی
این مقاله بخشی از پایاننامه دکتری فریدا صادقی فاضل، گروه تربیت بدنی، دانشگاه آزاد اسلامی واحد نیشابور است.
مشارکت نویسندگان
مفهومسازی و نظارت: رامبد خواجهای و امیر رشید لمیر؛ روششناسی: امیر رشید لمیر؛ تجزیهو تحلیل دادهها: فریدا صادقی فاضل و اکبر صفی پور افشار؛ گردآوری اطلاعات و تأمین مالی و منابع: فریدا صادقی فاضل؛ بررسی، نگارشـپیشنویس اصلی و نگارشـبررسی و ویرایش: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از همه شرکتکنندگان در این تحقیق تشکر و قدردانی میشود.
مطالعه حاضر به بررسی تأثیر 8 هفته تمرین هوازی همراه با تمرینات مقاومتی در بیان ژنهای ABCG5 و ABCG8 در بیماران عمل قلب باز پرداخته است. مطالعه حاضر نشان داد 8 هفته تمرین هوازی همراه با تمرینات مقاومتی، بیان ژنهای ABCG5 و ABCG8 را در بیماران عمل قلب باز افزایش میدهد که میتواند منجر به کاهش بیماریهای قلبیعروقی شود.
یکی از خطرناکترین بیماریهای قلبی مربوط به بیماریهای عروق کرونری است که عمدتاً تحت عنوان موارد گرفتگی عروق کرونری معرفی میشوند. این نوع بیماری موجب کاهش خاصیت ارتجاعی دیواره رگها شده که دلیل آن تشکیل پلاکهای آتروسلروتیک و افزایش ضخامت عروق بهدلیل تجمیع کلسترول میباشد [22]. افزایش ناهنجاریهای اندوتلیال برخی انتقالدهندههای کلسترول در سطح غشای اندوتلیال در بیان و عملکرد سرکوب شده که منجر به افزایش بیماریهای قلبیعروقی میشود [23] و شامل کاهش بیان و عملکرد ناقص عوامل انتقال معکوس کلسترول با نام بسته پروتئینهای وابسته به ATP (ABC) میباشد؛ بهنحوی که این بیماران را در مقابل مداخلاتی که در جهت مرتبسازی رونوشت جهت افزایش انتقالدهنده کلسترول میباشد، مقاوم میسازد. بنابراین، مکانیزمهایی که انتقالدهندههای ABC را مختل میکند یا بر مسیرهای سلولی واقعی تأثیر میگذارند، میبایست مستقیماً درمان شوند [24].
خانواده ABC به ترتیبهای مختلفی تقسیم میشود که ABCG بزرگترین زیرمجموعه خانواده ABC است که انتقالدهنده مهم لیپید میباشد و دارای زیرخانوادههای متعددی ازجمله ABCG26, ABCG12, ABCG11, ABCG8, ABCG5, ABCG 4, ABCG3 ABCG2 و ABCG1 میباشد [25, 26 ,27, 28, 29 ,30]. تمامی این ABCG ها بهجز ABCG2 نقش مهمی در فرآیند انتقال معکوس کلسترول دارند. درواقع، 2 عضو خانواده انتقالدهنده ABC، یعنی ABCG5 و ABCG8 که هترودیمریک بوده و اغلب در کبد و روده کوچک بیان میشوند. جذب استرول را در روده محدود میکند و ترشح صفرایی را ازطریق کلسترولهای ایجادشده در کبد افزایش میدهد. انتقالدهندههای ABCG5 و ABCG8 ازطریق گیرندههای هپاتیک X کنترل میشوند [31, 32, 33, 34 ,35]. به بیان دیگر، LXR از طریق بیان بیش از حد ABCG5 و ABCG8 موجب ایجاد اسید صفرا می شود و کلسترول را در صفرا ترشح میکند که تقویتکننده دفع مدفوعی کلسترول درون رودهها میباشد [17, 36, 37, 38].
بیان بیش از اندازه انتقالدهندههای ژن ABCG5 و ABCG8 در موشها کلسترول غذایی را تا 50 درصد ازطریق افزایش ترشح صفرایی استرول کاهش میدهد. درعوض، ناهنجاریها در هر 2 ژن در موشها منجر به افزایش 3 برابری در جذب استرول در گیاهان غذایی شده که موجب افزایش سطوح سیتواسترول پلاسما تا 30 درصد به همراه کاهش سطوح کلسترول صفرایی میشود [26]. مزایای این انتقالدهندهها در هموستاز کلسترول آنها را اهداف درمانی مهم برای جلوگیری از بیماریهای گرفتگی قلبیعروقی بدل کرده است. باوجوداین، گرچه بسیاری از مطالعات نشان دادهاند که فعالیتهای ورزشی بیان انتقالدهندههای کلسترول را افزایش میدهند و بر سطوح کلسترول خون تأثیر میگذارند [29 ,30 ,31]، اما مهمترین بخش این مطالعات در راستای بررسی تأثیر فعالیتهای فیزیکی بر مکانیزمهای بیان ژنهای دخیل در فرآیند انتقال معکوس کلسترول میباشد که شامل خانواده انتقالدهنده ABC، بهویژه گونه G اغلب متمرکزشده در حیوانات میباشد که نشاندهنده شکاف دانشی درخصوص تأثیر این امر بر انسانها است [27، 28].
در این راستا، گروهی از محققین چنین گزارش کردهاند که سطح بیان ژن ABCG5 در موشهای ماده اسپراگوئه داولی پس از فعالیت هوازی با شدت متوسط بر روی تردمیل کاهش یافت (6 هفته دو افزایشی از 15 متر/دقیقه با صفر درصد شیب 15 دقیقه در روز (2 هفته) تا 60 دقیقه در روز با سرعت 26 متر در دقیقه با 10 درصد شیب (4 هفته) 5 مرتبه بهصورت هفتگی) [28]. بهعلاوه، مطالعات دیگر به بررسی تأثیر تمرین بر بیان ژن ABCG5 در بافت روده موشهای ماده پرداختند و یافتههای آنها نشان میدهد که بیان این ژن پس از تمرین (6 هفته دو افزایشی با سرعت 15 متر/دقیقه و شیب صفر درصد و 15 دقیقه در روز تا 60 دقیقه در روز با سرعت 26 متر در دقیقه و شیب 10 درصد، 5 بار در هفته) افزایش یافته است [39]. در مطالعه قنبری نیاکی و همکاران چنین گزارش میشود که بیان نسبی ژن ABCG5 چربی اطراف شکم پس از تمرین هوازی برروی تردمیل افزایش یافته است [40]. باوجوداین، حسینی و همکاران به بررسی تأثیر تمرینات هوازی و تمرینات با شدت بالا بر بیان ژنهای ABCG4, ABCG5 و ABCG8 در ماهیچه ورزشکاران پرداختند. نتایج آنها نشان داد که یک جلسه تمرین هوازی و تمرین با شدت بالا بیان ژنهای دخیل در انتقال کلسترول را در مقایسه با گروه کنترل تحریک کرده، اما هیچگونه تفاوت معناداری میان دو گروه آزمایشی دیده نشده است [41].
برنامههای توانبخشی بخش مهمی از فرآیند درمان در راستای بازگرداندن بیمار به شرایط فیزیکی، روانی و اجتماعی بهینه هستند [42]. درواقع، چنین نشان داده شده است که امید به زندگی پس از بهبود قلبی بهطرز چشمگیری افزایش مییابد که نشاندهنده مزایای این نوع استراتژیها میباشد. برنامههای تمرینی مرگومیر ناشی از بیماریهای قلبیعروقی را حدود 20 تا 25 درصد و مرگ بهدلیل بیماری قلبیعروقی را 22 تا 25 درصد 3 سال پس از بررسیهای ثانویه کاهش داده است. توانبخشی بهعنوان یک تسهیلگر در کنترل عوامل ریسک در این افراد میباشد. ازآنجاکه توانبخشی میتواند فرآیند بیماری را کند یا به تأخیر بیاندازد [42, 43, 44, 45].
براساس یافتههای تحقیق حاضر و در کنار دیگر مطالعات حیوانی، میتوان چنین بیان کرد که ترکیب تمرینهای هوازی و تمرینهای مقاومتی در بهبود انتقال معکوس کلسترول ازطریق بیان ژنهای ABCG5 و ABCG8 مؤثر است و بهعنوان درمانی پیشگیریکننده برای بیماران عمل قلب باز مطرح میباشد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه با کد اخلاقی IR.IAU.NEYSHABUR.REC.1398.013 در دانشگاه آزاد اسلامی واحد نیشابور تأیید شده است.
حامی مالی
این مقاله بخشی از پایاننامه دکتری فریدا صادقی فاضل، گروه تربیت بدنی، دانشگاه آزاد اسلامی واحد نیشابور است.
مشارکت نویسندگان
مفهومسازی و نظارت: رامبد خواجهای و امیر رشید لمیر؛ روششناسی: امیر رشید لمیر؛ تجزیهو تحلیل دادهها: فریدا صادقی فاضل و اکبر صفی پور افشار؛ گردآوری اطلاعات و تأمین مالی و منابع: فریدا صادقی فاضل؛ بررسی، نگارشـپیشنویس اصلی و نگارشـبررسی و ویرایش: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
از همه شرکتکنندگان در این تحقیق تشکر و قدردانی میشود.
References
1.Nazari N, Hashemi-Javaheri AA, Rashid-Lami A, Alaviniya E. Effect of cardiac rehabilitation on strength and balance in patients after coronary artery bypass graft. Zahedan Journal of Research in Medical Sciences. 2013; 16(1):74-8. [Link]
2.Oram JF. HDL apolipoproteins and ABCA1: partners in the removal of excess cellular cholesterol. Arteriosclerosis, thrombosis, and Vascular Biology. 2003; 23(5):720-7. [DOI:10.1161/01.ATV.0000054662.44688.9A]
3.Askari B, Rashidlamir A, Askari A, Habibian M, Saadatniya A. Effect of eight weeks of cardiac rehabilitation training on PPAR-α gene expression in CABG patients. Medical Laboratory Journal. 2018; 12(2):27-31. [DOI:10.29252/mlj.12.2.27]
4.Hattori H, Kujiraoka T, Egashira T, Saito E, Fujioka T, Takahashi S, et al. Association of coronary heart disease with pre-β-HDL concentrations in Japanese men. Clinical Chemistry. 2004; 50(3):589-95. [DOI:10.1373/clinchem.2003.029207]
5.Justice JE. Management of cholesterol in the diabetic patient [MSc, thesis]. United States: Northern Kentucky University; 2004. [Link]
6.Yeboah J. more-intensive vs less-intensive LDL-cholesterol lowering reduces mortality. Annals of internal medicine. 2018; 169(2):JC6.[DOI:10.7326/ACPJC-2018-169-2-006]
7.Axmann M, Strobl WM, Plochberger B, Stangl H. Cholesterol transfer at the plasma membrane. Atherosclerosis. 2019; 290:111-7. [DOI:10.1016/j.atherosclerosis.2019.09.022]
8.Rashidlamir A, Saadatnia A, Ebrahimi-Atri A, Delphan M. Effect of eight weeks of wrestling and circuit fitness training on APO lipoprotein AI and lymphocyte ABCA1 gene expression in well-trained wrestlers. International Journal of Wrestling Science. 2011; 1(2):48-53. [DOI:10.1080/21615667.2011.10878931]
9.Yu XH, Qian K, Jiang N, Zheng XL, Cayabyab FS, Tang CK. ABCG5/ABCG8 in cholesterol excretion and atherosclerosis. Clinica Chimica Acta. 2014; 428:82-8. [DOI:10.1016/j.cca.2013.11.010]
10.Lee JY, Kinch LN, Borek DM, Wang J, Wang J, Urbatsch IL, et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 2016; 533(7604):561-4. [DOI:10.1038/nature17666]
11.Zein AA, Kaur R, Hussein TO, Graf GA, Lee JY. ABCG5/G8: A structural view to pathophysiology of the hepatobiliary cholesterol secretion. Biochemical Society Transactions. 2019; 47(5):1259-68. [DOI:10.1042/BST20190130]
12.Tada H, Okada H, Nomura A, Takamura M, Kawashiri MA. Beneficial effect of ezetimibe-atorvastatin combination therapy in patients with a mutation in ABCG5 or ABCG8 gene. Lipids in Health and Disease. 2020; 19(1):3.[DOI:10.1016/S0735-1097(19)32342-3]
13.Neumann J, Rose-Sperling D, Hellmich UA. Diverse relations between ABC transporters and lipids: An overview. Biochimica et Biophysica Acta. Biomembranes. 2017; 1859(4):605-18.[DOI:10.1016/j.bbamem.2016.09.023]
14.Tiainen S, Kiviniemi A, Hautala A, Huikuri H, Ukkola O, Tokola K, et al. Effects of a two-year home-based exercise training program on oxidized LDL and HDL lipids in coronary artery disease patients with and without type-2 diabetes. Antioxidants. 2018; 7(10):144. [DOI:10.3390/antiox7100144]
15.Ahn N, Kim K. High-density lipoprotein cholesterol (HDL-C) in cardiovascular disease: Effect of exercise training. Integrative Medicine Research. 2016; 5(3):212-5. [DOI:10.1016/j.imr.2016.07.001]
16.Ruiz-Ramie JJ, Barber JL, Sarzynski MA. Effects of exercise on HDL functionality. Current opinion in lipidology. 2019; 30(1):16-23. [DOI:10.1097/MOL.0000000000000568]
17.Miozzo AP, Stein C, Marcolino MZ, Sisto IR, Hauck M, Coronel CC, et al. Effects of high-intensity inspiratory muscle training associated with aerobic exercise in patients undergoing CABG: randomized clinical trial. Brazilian journal of Cardiovascular Surgery. 2018; 33(4):376-83. [DOI:10.21470/1678-9741-2018-0053]
18.Ghanbari-Niaki A, Rahmati-Ahmadabad S, Zare-Kookandeh N. ABCG8 gene responses to 8 weeks treadmill running with or without Pistachia atlantica (Baneh) extraction in female rats. International journal of endocrinology and metabolism. 2012; 10(4):604-10. [DOI:10.5812/ijem.5305]
19.Wang J, Mitsche MA, Lütjohann D, Cohen JC, Xie XS, Hobbs HH. Relative roles of ABCG5/ABCG8 in liver and intestine. Journal of lipid research. 2015; 56(2):319-30. [DOI:10.1194/jlr.M054544]
20.LeCheminant JD, Tucker LA, Bailey BW, Peterson T. The relationship between intensity of physical activity and HDL cholesterol in 272 women. Journal of Physical Activity and Health. 2005; 2(3):333-44. [DOI:10.1123/jpah.2.3.333]
21.Elmer DJ, Laird RH, Barberio MD, Pascoe DD. Inflammatory, lipid, and body composition responses to interval training or moderate aerobic training. European journal of applied physiology. 2016; 116(3):601-9.[DOI:10.1007/s00421-015-3308-4]
22.Glenney SS, Brockemer DP, Ng AC, Smolewski MA, Smolgovskiy VM, Lepley AS. Effect of exercise training on cardiac biomarkers in at-risk populations: a systematic review. Journal of Physical Activity and Health. 2017; 14(12):968-89. [DOI:10.1123/jpah.2016-0631]
23.Kodama S, Tanaka S, Saito K, Shu M, Sone Y, Onitake F, et al. Effect of aerobic exercise training on serum levels of high-density lipoprotein cholesterol: A meta-analysis. Archives of internal medicine. 2007; 167(10):999-1008. [DOI:10.1001/archinte.167.10.999]
24.Rashidlamir A, Dastani M, Saadatnia A, Bassami MR. Effect of cardiac rehabilitation training on ABCA1 expression in lymphocytes of patients undergoing coronary artery bypass graft operation. Zahedan Journal of Research in Medical Sciences. 2018; 20(6):e11277. [DOI:10.5812/zjrms.11277]
25.Benjamin EJ, Virani SS, Callaway CW, Chamberlain AM, Chang AR, Cheng S, et al. Heart disease and stroke statistics-2018 update: a report from the American Heart Association. Circulation. 2018; 137(12):e67-492. [DOI:10.1161/CIR.0000000000000573]
26.Rashidlamir A. [Investigation of the effect of aerobic and resistance exercises on peripheral blood mononuclear cells ABCG1 gene expression in female athletes (Persian)]. Journal of Shahid Sadoughi University of Medical Sciences. 2012; 20(1):1-9. [Link]
27.Rahmati-Ahmadabad S, Broom DR, Ghanbari-Niaki A, Shirvani H. Effects of exercise on reverse cholesterol transport: A systemized narrative review of animal studies. Life Sciences. 2019; 224:139-48. [DOI:10.1016/j.lfs.2019.03.058] [PMID]
28.Ma Z, Deng C, Hu W, Zhou J, Fan C, Di S, et al. Liver X receptors and their agonists: targeting for cholesterol homeostasis and cardiovascular diseases. Current issues in molecular biology. 2017; 22:41-64. [DOI:10.21775/cimb.022.041] [PMID]
29.Patel SB, Graf GA, Temel RE. Thematic review series: Lipid transfer proteins ABCG5 and ABCG8: more than a defense against xenosterols. Journal of lipid research. 2018; 59(7):1103-13. [DOI:10.1194/jlr.R084244]
30.Wilund KR, Feeney LA, Tomayko EJ, Weiss EP, Hagberg JM. Effects of endurance exercise training on markers of cholesterol absorption and synthesis. Physiological research. 2009; 58(4):545-52. [DOI:10.33549/physiolres.931515]
31.Ngo Sock ET, Farahnak Z, Lavoie JM. Exercise training decreases gene expression of endo-and xeno-sensors in rat small intestine. Applied Physiology, Nutrition, and Metabolism. 2014; 39(10):1098-103.[DOI:10.1139/apnm-2013-0573]
32.Rocco DD, Okuda LS, Pinto RS, Ferreira FD, Kubo SK, Nakandakare ER, et al. Aerobic exercise improves reverse cholesterol transport in cholesteryl ester transfer protein transgenic mice. Lipids. 2011; 46(7):617-25. [DOI:10.1007/s11745-011-3555-z] [PMID]
33.Marinangeli CP, Varady KA, Jones PJ. Plant sterols combined with exercise for the treatment of hypercholesterolemia: overview of independent and synergistic mechanisms of action. The Journal of nutritional biochemistry. 2006; 17(4):217-24.[DOI:10.1016/j.jnutbio.2005.09.003]
34.Rashidlamir A, Ghanbari-Niaki A, Saadatnia A. The Effect of eight weeks of wrestling and wrestling technique based circuit training on lymphocyte ABCA1 gene expression and plasma apolipoprotein AI. World Journal of Sport Sciences. 2011; 4(2):144-50. [Link]
35.Degirolamo C, Sabba C, Moschetta A. Intestinal nuclear receptors in HDL cholesterol metabolism. Journal of Lipid Research. 2015; 56(7):1262-70. [DOI:10.1194/jlr.R052704] [PMCID]
36.Wang HH, Garruti G, Liu M, Portincasa P, Wang DQ. Cholesterol and lipoprotein metabolism and atherosclerosis: recent advances in reverse cholesterol transport. Annals of Hepatology. 2017; 16(S 1):S27-42.[DOI:10.5604/01.3001.0010.5495]
37.Divine JK, Staloch LJ, Haveri H, Jacobsen CM, Wilson DB, Heikinheimo M, et al. GATA-4, GATA-5, and GATA-6 activate the rat liver fatty acid binding protein gene in concert with HNF-1α. American Journal of Physiology. Gastrointestinal and Liver Physiology. 2004; 287(5):G1086-99. [DOI:10.1152/ajpgi.00421.2003]
38.Broderick TL, Parrott CR, Wang D, Jankowski M, Gutkowska J. Expression of cardiac GATA4 and downstream genes after exercise training in the db/db mouse. Pathophysiology. 2012; 19(3):193-203. [DOI:10.1016/j.pathophys.2012.06.001]
39.Xiao J, Xu T, Li J, Lv D, Chen P, Zhou Q, et al. Exercise-induced physiological hypertrophy initiates activation of cardiac progenitor cells. International journal of Clinical and Experimental Pathology. 2014; 7(2):663-9. [PMID]
40.Broderick TL, Wang D, Jankowski M, Gutkowska J. Unexpected effects of voluntary exercise training on natriuretic peptide and receptor mRNA expression in the ob/ob mouse heart. Regulatory peptides. 2014; 188:52-9.[DOI:10.1016/j.regpep.2013.12.005]
41.Jafari M. [Effect of physical activity on prevention and treatment of atherosclerosis: focus on activity of ABCG5 and ABCG8 genes (Persian)]. Journal of Gorgan University of Medical Sciences. 2019; 21(3):13-23. [Link]
42.Côté I, Ngo Sock ET, Lévy É, Lavoie JM. An atherogenic diet decreases liver FXR gene expression and causes severe hepatic steatosis and hepatic cholesterol accumulation: effect of endurance training. European journal of nutrition. 2013; 52(5):1523-32. [DOI:10.1007/s00394-012-0459-5]
43.Ghanbari-Niaki A, Kookandeh NZ, Kookandeh AZ. ABCG5 gene responses to treadmill running with or without administration of Pistachio atlantica in female rats. Iranian Journal of Basic Medical Sciences. 2014; 17(3):162-71. [doi:10.22038/ijbms.2014.2401]
44.Hosseini Sm, Darrudi S, Talebi K, Rashidlamir A. [Effect of hit and aerobic exercises on ABCG4, ABCG5 and ABCG8 gene expression female athletes (Persian)]. International Sports Science Conference. 2017; (4). [Link]
45.Taylor RS, Brown A, Ebrahim S, Jolliffe J, Noorani H, Rees K, et al. Exercise-based rehabilitation for patients with coronary heart disease: Systematic review and meta-analysis of randomized controlled trials. The American Journal of Medicine. 2004; 116(10):682-92. [DOI:10.1016/j.amjmed.2004.01.009]
نوع مطالعه: پژوهشی |
موضوع مقاله:
فيزيولوژی پزشکی
دریافت: 1400/11/4 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
دریافت: 1400/11/4 | پذیرش: 1401/4/1 | انتشار: 1401/4/10
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |