

دوره 28، شماره 4 - ( پاییز 1401 )
جلد 28 شماره 4 صفحات 433-422 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Tehranian F, Nezami H, Maivan M H J, Akbarzadeh Sani J, Hajavi J. Investigating the Frequency of Delta 32 (∆32) Mutation Related to CCR5 Chemokine Receptor in Patients at Gonabad Health Centers, Iran. Intern Med Today 2022; 28 (4) :422-433
URL: http://imtj.gmu.ac.ir/article-1-3932-fa.html
URL: http://imtj.gmu.ac.ir/article-1-3932-fa.html
طهرانیان فائزه، نظامی حسین، جعفرزاده مایوان محمدحسین، اکبرزاده ثانی جواد، حاجوی جعفر. بررسی فراوانی جهش دلتا32 (32∆) مربوط به گیرنده کموکاینی CCR5 در مراجعین به مراکز بهداشت گناباد. طب داخلی روز. 1401; 28 (4) :422-433
1- مرکز تحقیقات بیماریهای عفونی، کمیته تحقیقات دانشجویی، دانشگاه علوم پزشکی گناباد، گناباد، ایران.
2- گروه اپیدمیولوژی و آمار زیستی، کمیته تحقیقات دانشجویی، دانشکده بهداشت، دانشگاه علوم پزشکی مشهد، مشهد، ایران.
3- بیمارستان علامه بهلول گنابادی، دانشگاه علوم پزشکی گناباد، گناباد، ایران.
4- گروه میکروبشناسی، مرکز تحقیقات بیماریهای عفونی، دانشکده پزشکی، دانشگاه علوم پزشکی گناباد، گناباد، ایران. ،hajavi.jaf@gmail.com
2- گروه اپیدمیولوژی و آمار زیستی، کمیته تحقیقات دانشجویی، دانشکده بهداشت، دانشگاه علوم پزشکی مشهد، مشهد، ایران.
3- بیمارستان علامه بهلول گنابادی، دانشگاه علوم پزشکی گناباد، گناباد، ایران.
4- گروه میکروبشناسی، مرکز تحقیقات بیماریهای عفونی، دانشکده پزشکی، دانشگاه علوم پزشکی گناباد، گناباد، ایران. ،
متن کامل [PDF 3401 kb]
(1089 دریافت)
| چکیده (HTML) (2791 مشاهده)
References
1.Hughes CE, Nibbs RJB. A guide to chemokines and their receptors. The FEBS Journal. 2018; 285(16): 2944-71. [DOI: 10. 1111/febs. 14466] [PMID] [PMCID]
2.Upadhyaya C, Jiao X, Ashton A, Patel K, Kossenkov AV, Pestell RG. The G protein coupled receptor CCR5 in cancer. Advances in Cancer Research. 2020; 145: 29-47. [DOI: 10. 1016/bs. acr. 2019. 11. 001] [PMID] [PMCID]
3.Vangelista L, Vento S. The expanding therapeutic perspective of CCR5 blockade. Frontiers in Immunology. 2017; 8: 1981. [DOI: 10. 3389/fimmu. 2017. 01981] [PMID] [PMCID]
4.Venuti A, Pastori C, Lopalco L. The role of natural antibodies to CC chemokine receptor 5 in HIV infection. Frontiers in Immunology. 2017; 8: 1358. [DOI: 10. 3389/fimmu. 2017. 01358] [PMID] [PMCID]
5.Zhang Y, Chen HF. Allosteric mechanism of an oximino-piperidino-piperidine antagonist for the CCR5 chemokine receptor. Chemical Biology & Drug Design. 2020; 95(1): 113-23. [DOI: 10. 1111/cbdd. 13627] [PMID]
6.Al-Jaberi SA, Ben-Salem S, Messedi M, Ayadi F, Al-Gazali L, Ali BR. Determination of the CCR5∆32 frequency in Emiratis and Tunisians and the screening of the CCR5 gene for novel alleles in Emiratis. Gene. 2013; 529(1): 113-8. [DOI: 10. 1016/j. gene. 2013. 07. 062] [PMID]
7.Youssef AI, Hassan AA, Mohammed SA, Ahmed HA. Distribution of the chemokine receptor-5 gene in Egyptian breast cancer patients. Benha Medical Journal. 2018; 35(1): 49. [Link]
8.Rautenbach A, Williams AA. Metabolomics as an approach to characterise the contrasting roles of CCR5 in the presence and absence of disease. International Journal of Molecular Sciences. 2020; 21(4): 1472. [DOI: 10. 3390/ijms21041472] [PMID] [PMCID]
9.Scurci I, Martins E, Hartley O. CCR5: Established paradigms and new frontiers for a ‘celebrity’ chemokine receptor. Cytokine. 2018; 109: 81-93. [DOI: 10. 1016/j. cyto. 2018. 02. 018] [PMID]
10.Atzeni F, Boiardi L, Casali B, Farnetti E, Nicoli D, Sarzi-Puttini P, et al. CC chemokine receptor 5 polymorphism in Italian patients with Behcet’s disease. Rheumatology (Oxford, England). 2012; 51(12): 2141-5. [DOI: 10. 1093/rheumatology/kes238] [PMID]
11.Juhász E, Béres J, Kanizsai S, Nagy K. The consequence of a founder effect: CCR5-32, CCR2-64I and SDF1-3’A polymorphism in vlach gypsy population in Hungary. Pathology Oncology Research: POR. 2012; 18(2): 177-82. [DOI: 10. 1007/s12253-011-9425-4] [PMID]
12.Gharagozloo M, Doroudchi M, Farjadian S, Pezeshki AM, Ghaderi A. The frequency of CCR5Δ32 and CCR2-64I in southern Iranian normal population. Immunology Letters. 2005; 96(2): 277-81. [DOI: 10. 1016/j. imlet. 2004. 09. 007] [PMID]
13.Farshbaf A, Biglari A, Faghihzadeh S, Esmaeilzadeh A. [Frequency of CCR5Δ32 allelic mutation in healthy individuals in Zanjan province (Persian)]. Journal of Advances in Medical and Biomedical Research. 2017; 25(108): 129-36. [Link]
14.Omrani D. Frequency of CCR5Δ 32 variant in north-west of Iran. Journal of Sciences, Islamic Republic of Iran. 2009; 20(2): 105-10. [Link]
15.Martinson JJ, Chapman NH, Rees DC, Liu YT, Clegg JB. Global distribution of the CCR5 gene 32-basepair deletion. Nature Genetics. 1997; 16(1): 100-3. [DOI: 10. 1038/ng0597-100] [PMID]
16.Libert F, Cochaux P, Beckman G, Samson M, Aksenova M, Cao A, et al. he deltaccr5 mutation conferring protection against HIV-1 in Caucasian populations has a single and recent origin in Northeastern Europe. Human Molecular Genetics. 1998; 7(3): 399-406. [DOI: 10. 1093/hmg/7. 3. 399] [PMID]
17.Papa A, Papadimitriou E, Adwan G, Clewley JP, Malissiovas N, Ntoutsos I, et al. HIV-1 co-receptor CCR5 and CCR2 mutations among Greeks. FEMS Immunology & Medical Microbiology. 2000; 28(1): 87-9. [DOI: 10. 1111/j. 1574-695X. 2000. tb01461. x] [PMID]
18.Govorovskaya I, Khromova E, Suslova T, Alexeev L, Kofiadi I. The Frequency of CCR5del32 mutation in populations of Russians, Tatars and Bashkirs of Chelyabinsk Region, Russia. Archivum Immunologiae et Therapiae Experimentalis. 2016; 64(Suppl 1): 109-12. [DOI: 10. 1007/s00005-016-0429-3] [PMID]
19.Badie BM, Najmabadi H, Djavid GE, Kheirandish P, Payvar F, Akhlaghkhah M, et al. Frequency of CCR5 delta 32 polymorphism and its relation to disease progression in Iranian HIV-1 positive individuals: P1200. Clinical Microbiology & Infection. 2010; 16. [DOI:10.15406/jhvrv.2015.02.00059]
20.Prahalad S. Negative association between the chemokine receptor CCR5-Delta32 polymorphism and rheumatoid arthritis: A meta-analysis. Genes and Immunity. 2006; 7(3): 264-8. [DOI:10. 1038/sj. gene. 6364298] [PMID] [PMCID]
21.Ruiz-Mateos E, Tarancon-Diez L, Alvarez-Rios AI, Dominguez-Molina B, Genebat M, Pulido I, et al. Association of heterozygous CCR5Δ32 deletion with survival in HIV-infection: A cohort study. Antiviral Research. 2018; 150: 15-9. [DOI: 10. 1016/j. antiviral. 2017. 12. 002] [PMID]
22.Heydarifard Z, Tabarraei A, Moradi A. Polymorphisms in CCR5Δ32 and Risk of HIV-1 Infection in the Southeast of Caspian Sea, Iran. Disease Markers. 2017; 2017: 4190107. [DOI: 10. 1155/2017/4190107] [PMID] [PMCID]
23.Zare-Bidaki M, Karimi-Googheri M, Hassanshahi G, Zainodini N, Arababadi MK. The frequency of CCR5 promoter polymorphisms and CCR5 Δ 32 mutation in Iranian populations. Iranian Journal of Basic Medical Sciences. 2015; 18(4): 312-6. [PMID]
متن کامل: (2103 مشاهده)
مقدمه
کموکاینها در توسعه و هموستاز سیستم ایمنی بدن بهدلیل توانایی خود در تحریک مهاجرت سلولها بهویژه لکوسیتها، نقش مهمی ایفا میکنند و در همه واکنشهای محافظتی یا مخرب ایمنی و التهابی نقش دارند. بااینحال، مهاجرت گلبولهای سفید تحت هدایت کموکاین همچنین به بیماریهایی که دارای اجزای ایمنی یا التهابی هستند مانند خودایمنی، آلرژی، بیماریهای التهابی مزمن، سرطان و بسیاری دیگر کمک میکنند [1].
گیرنده CCR5 یک گیرنده شیمیایی هپتامر از خانواده G-coupled پروتئینها است. این گیرنده در شرایط التهابی ایجاد میشود و نقش مهمی در جذب لکوسیتهای دخالتکننده در سیستم دفاعی بدن دارد [2].
آلودگی به ویروس HIV بهعنوان یک معضل اجتماعی مهم، سلامت جامعه را به خطر میاندازد. با وجود تلاشها و برنامهریزیهای گسترده سازمان بهداشت جهانی، انتشار بالای بیماری HIV همواره سبب ایجاد زیانهای اقتصادی، اجتماعی و بهداشتی شده است [3].
ویروس HIV برای ورود به سلول از گیرندههای شیمیایی مختلفی از جمله CCR5 و CXCR4 استفاده میکند [3]، CCR5 مهمترین گیرنده مشترک در مراحل اولیه عفونت است و بیشتر افراد آلوده به این ویروس تنها از این طریق مبتلا شدهاند [4, 5]. همچنین انتقال این ویروس از فردی به فرد دیگر تقریباً بهصورت انحصاری به این گیرنده محدود میشود [3].
مطالعات ژنتیکی نشان میدهد این ژن حاوی 4 اگزون بر روی کروموزوم شماره 3 است [6]، اما فقط اگزون 4 قابلیت بیان شدن دارد. برخی افراد بهطور ارثی دارای یک جهش 32 جفت بازی (∆32) در اگزون ژن این گیرنده میباشند [3]. افراد دارای جهش 23∆، مولکول CCR5 را بر سطح سلولهای خود بیان نمیکنند و یا فرم غیر عملکردی و ناقص این مولکول را بیان میکنند، بنابراین باتوجهبه اهمیت گیرنده CCR5 در ایجاد کموتاکسی مناسب سلولهای ایمنی و همچنین نقش آن در آلودگی لنفوسیتهای T و ماکروفاژها به HIV، جهش32∆ در ژن این مولکول میتواند با تغییر عملکرد در سلولهای ایمنی و همچنین مقاومت نسبی به HIV همراه باشد [7]. فراوانی این جهش در مناطق جغرافیایی و قومیتهای مختلف متفاوت است [6]. ازاینرو بررسی این مولکول ازنظر همهگیرشناسی نیز حائز اهمیت است. بسته به عوامل خاص مانند الگوی بیماری، جغرافیای نمونهها و گروه خونی مورد مطالعه نقش CCR5 در بیماری، متفاوت است [8].
باتوجهبه تحقیقات انجامشده کمبود CCR5 در افراد بهعلت جبران توسط سایر گیرندههای شیمیایی و لیگاندهای آنها احساس نمیشود و افراد میتوانند بهطور نرمال رشد کنند [9]. زمانی که فردی در جهش CCR5-∆32 هموزیگوس باشد، بهعلت اینکه هیچ رسپتوری در سطح سلولها بیان نمیشود، نسبت به HIVمقاوم و زمانی که هتروزیگوس باشد، تعداد کمی رسپتور در سطح سلول بیان میشود که سبب کاهش پیشرفت بیماری [10] یا حتی تأخیر در ابتلا فرد بهHIV میشود [11].
برنامههای کاربردی موفق از مدلهای مبتنی بر لیگاند و بینشهای اخیر در مورد مکانیسم HIV یک استراتژی جدید را با هدف جلوگیری از چسبندگی و گسترش ویروسی آغاز کرده است. یک رویکرد امیدوارکننده، مبتنی بر بهکارگیری عواملی است که قادر به متوقف کردن تعامل پروتئینهای ویروسی با گیرنده غشای سلولی میزبان CD4 و گیرندههای CCR5 و CXCR4 هستند. همچنین گیرنده CCR5 ممکن است درزمینه توسعه بسیاری از بیماریهای دیگر چون سرطانها و هپاتیت و آنفولانزا و بیماریهای خودایمنی مانند مالتیپل اسکلروزیس و آرتریت روماتوئید مؤثر باشد [3, 8, 12-14].
باتوجهبه اهمیت جهش دلتا 32 در ایجاد مقاومت نسبت به بیماریهای مختلف بهویژه عفونت ویروس HIV، ما نیز بر آن شدیم تا در این پژوهش به بررسی میزان شیوع این جهش در افراد مراجعهکننده به مرکز بهداشت گناباد باتوجهبه شرایط موجود بپردازیم.
مواد و روشها
در این مطالعه توصیفیمقطعی، جامعه مورد مطالعه افراد سالم شهر گناباد بودند که با دارا بودن معیارهای ورود شامل سن بالای 18سال و عدم ابتلا به بیماریهایی همانند دیابت، هپاتیت، بیماریهای خود ایمنی و غیره طبق اظهارنظر فرد، وارد مطاالعه شدند. با استفاده از روش نمونهگیری مبتنی بر هدف، 293 نفر وارد مطالعه شدند. نمونهگیری با هماهنگی معاونت بهداشت دانشگاه از مراجعین به مرکز بهداشت بعد از توضیح کامل طرح و اهمیت موضوع و دریافت رضایتنامه کتبی و پس از ورود به مطالعه انجام میشود و پس از انجام تست سریع (کیت ABON)، براساس تکنولوژی ایمونوکروماتوگرافی عمل میکند، مقدار 5 سیسی خون وریدی در نمونههای حای ضدانعقاد EDTA از افراد گرفته شد و نمونهها در شرایط سرد به آزمایشگاه ایمونولوژی دانشکده پیراپزشکی منتقل و استخراج DNA با روش ستونی(کیت شرکت کارمانیا پارس ژن) و استریل انجام شد. سپس جهش با روش مولکولی PCR با استفاده از کیت شرکت کارمانیا پارس ژن، بررسی شد و نتایج پس از ران کردن محصول PCR مربوط به نمونهها بر روی ژل آگارز 3 درصد و مشاهده وجود یا عدم وجود باند مربوطه به DNA تحلیل شد.
روش تجزیهوتحلیل آماری
دادههای گردآوریشده وارد نرمافزار SPSS نسخه 22 شدند و پس از اطمینان از صحت ورود دادهها، دادههای متغیرهای کیفی با جداول توزیع فراوانی( تعداد و درصد)و دادههای کمی با میانگین و انحرافمعیار توصیف شدند. برای مقایسه فراوانی مشاهدات در سطوح متغیرهای کیفی از آزمون کایاسکوئر استفاده شد. در این مطالعه سطح معنادار 0/05 استفاده شده است.
یافته ها
مطالعه حاضر به جهت بررسی فراوانی جهش دلتا32 (23∆) مربوط به گیرنده کموکاینی CCR5در مراجعین به مرکز بهداشت شهرستان گناباد و ارتباط آن با خصوصیات جمعیتشناختی و برخی از بیماریها در سالهای 1397 تا 1398 انجام شده است. در این مطالعه دادههای 293 فرد تجزیهوتحلیل شد. میانگین سنی افراد تحت مطالعه 10/84±53/22 سال بود. 65 نفر زن (23/2 درصد) و 225 نفر مرد (8/ درصد 76) بودند. 293 افراد مراجعهکننده به مرکز بهداشت ژن بهترتیب 269 نفر (91/8 درصد) 3 حالت سالم (188bp)، 15 نفر (5/1 درصد) هتروزیگوت (188bp و 156bp) و 9 نفر (3/1) هموزیگوت (156bp) بودند (جدول شماره 1).

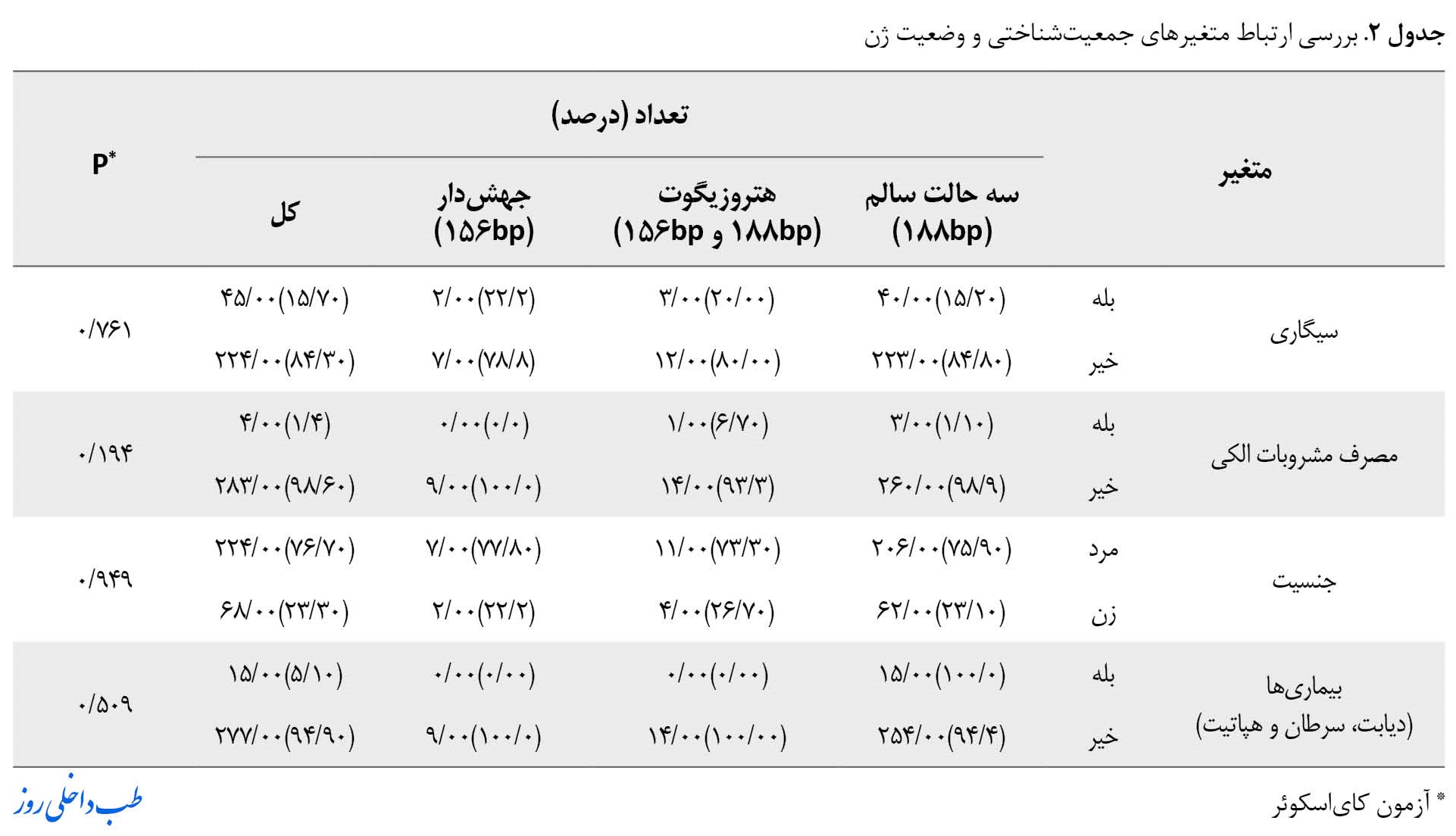
باتوجهبه جدول شماره 2، نتایج آزمون کایاسکوئر نشان داد هیچ ارتباط معناداری بین متغیر ژن با متغیرهای جمعیتشناختی ( سیگاری بودن، مصرف مشروبات الکی، جنسیت و بیماریها (دیابت، سرطان و هپاتیت) وجود ندارد.
بحث
طبق آمارهای سازمان بهداشت جهانی در پایان سال 2018 حدود 9/37 میلیون نفر مبتلا به ویروس HIV در کل جهان گزارش شده است. در واقع، ایرانیان بهعنوان یک جمعیت قفقازی بسیار مختلط در نظر گرفته میشوند که دلایل متعددی ممکن است دلیل تنوع ژنتیکی گسترده آنها باشد [12]. از طرف دیگر باتوجهبه مطالعات قبلی در ایران، شرایط جغرافیایی و قومیتهای مختلف، جهش دلتا32 از شیوع متفاوتی برخوردار میباشد.
باتوجهبه اهمیت این گیرنده در درمان و پیشگیری HIV، مطالعه حاضر با هدف بررسی فراوانی جهش دلتا32 (32∆) مربوط به گیرنده کموکاینی CCR5 در مراجعین به مرکز بهداشت شهرستان گناباد در سالهای 1397و 1398 انجام شد.
نتایج نشان داد از293 افراد مراجعهکننده به مرکز بهداشت، بهترتیب 269 نفر (91/8 درصد) ژن سالم و بدون جهش(188bp)، 15 نفر (5/1 درصد) جهش هتروزیگوت (188bp و 156bp) و 9 نفر (3/1) جهش هموزیگوت بر روی هر دو آلل CCR5(156bp)را دارا بودند.
برخلاف مطالعه حاضر، مطالعه فرشباف و همکاران در 200 فرد سالم در زنجان نشان داد فقط 1 نفر (0/5 درصد)، ازنظر این جهش هموزیگوت میباشند [13]. در مطالعه حاضر افراد هتروزیگوت 5/1 درصد بودند، درحالیکه در مطالعه عمرانی در 190 فرد سالم در ارومیه نشان داد که فراوانی جهش دلتا 32 هتروزیگوت 2/1 درصد میباشد [14].
برخلاف این مطالعه جهش هتروزیگوت دلتا32 در شمال اروپا مربوط به جمعیت قفقازی با 16 درصد (هتروزیگوت) و 1 درصد(هموزیگوت) میباشد و در کشورهای فنلاند، سوئد ایسلند و شمال روسیه 15 تا 16 درصد میباشد [15، 16]. این فراوانی در کشورهای مرکز و غرب اروپا به 10 درصد و در جنوب اروپا (یونان و پرتقال) به 4تا 6 درصد، کاهش مییابد [15، 17]. جهش هتروزیگوت در جنوب اروپا تقریباً مشابه با مطالعه حاضر (5/1 درصد) میباشد.
مطالعه انجامشده در روسیه در 300 فرد سالم نشان داد که ازنظر جهش دلتا 32، 79 نفر (18/33 درصد) هتروزیگوت و 7 نفر (1/67 درصد) هموزیگوت بودند [18] که جهش هتروزیگوت نسبت به مطالعه حاضر 3 برابر بود، اما مطالعه هموزیگوت کمتر از مطالعه ما بود.
مطالعه قرهگوزلو و همکاران در 395 فرد سالم در استان فارس نشان داد که افراد ازنظر جهش دلتا32، 97/2 درصد سالم، 2/8 درصد هتروزیگوت میباشند و هیچ فرد هموزیگوت شناسایی نشد [12].
در مطالعه گواروسکایا و همکاران با هدف بررسی فراوانی جهش CCR5-∆32 در جمعیت روس، تاتار و باشکیرهای استان چلبابینسک، 7 نفر هموزیگوس و 79 نفر هتروزیگوس شناسایی شدند [18]. بادی و همکاران در مطالعه مقطعی از بین 200 نفر مبتلا به HIV که به بیمارستان امام خمینی تهران مراجعه کرده بودند و بیماری آنها تأیید شده بود، بهطور تصادفی 194 بیمار وارد مطالعه شدند که از این تعداد فقط 8 نفر از نظر CCR5-∆32 هتروزیگوت بودند و هیچ هموزیگوت شناسایی نشد [19]. برخلاف مطالعه حاضر در مطالعه مقطعی در امارات و تونس که الجابری و همکاران انجام دادند، نشان داده شد این جهش بسیار نادر بوده است، بهطوریکه هیچ هموزیگوت در جمعیت مورد مطالعه یافت نشد و در بین افراد اماراتی تنها 1 نفر و در تونسیها نیز 4 هتروزیگوت بودهاند [6]. مطالعه فراتحلیلی که در دانمارک پراهالاد منتشر کرده است، اذعان کرد که این نتایج بهشدت نشاندهنده این است که آلل CCR5-∆32 سبب حفاظت افرادی با نژاد اروپایی در مقابل این بیماری میشود و افراد هموزیگوت در این جهش تأثیر محافظتی بیشتری را نسبت به هتروزیگوت نشان میدهند [20]. همانطورکه در مطالعات پیشگفت نشان میدهد شیوع این جهش در مناطق جغرافیایی و قومیتهای مختلف میتواند متفاوت باشد.
برخلاف مطالعه حاضر، رویز-ماتئوس و همکاران در مطالعه خود به تأیید و گسترش نقش CCR5-∆32 بهعنوان عامل پیشبینیکننده برای بقا در عفونت HIV و همچنین افزایش طول مدت بقا در افرادی که درمان ترکیبی ضدرترو ویروسی را دریافت کردهاند، میپردازد، اما در این مطالعه هیچ جهش هموزیگوت یافت نشد [21].
نتایج مطالعه مقطعی که حیدریفرد و همکارن انجام دادند، نشان میدهد جهش دلتا32 در افراد هتروریگوت حساسیت آنها به عفونت HIV را تحت تأثیر قرار نمیدهد [22].
در مطالعه مروری زارعبیدکی و همکاران نشان داده شد براساس دادههای موجود احتمال دارد جهش CCR5-∆32 در جمعیت عادی ایرانیها شایع نباشد [23].
باتوجهبه نتایج مطالعات یادشده و مطالعه حاضر، از جهت مؤثر بودن جهش CCR5-∆32 در برابر بیماریهای مختلف بهویژه HIV همراستا نبوده است و احتمالاً میتواند بهعلت متفاوت بودن مناطق جغرافیایی و یا قومیت مختلف آنها و یا حتی تفاوت در تعداد نمونه مطالعات باشد.
نتایج بهدستآمده از مطالعه حاضر هیچ ارتباط معناداری بین متغیر ژن با متغیرهای جمعیتشناختی (سیگاری بودن، مصرف مشروبات الکی، جنسیت و بیماریها (دیابت، سرطان و هپاتیت) را نشان نمیدهد. همچنین بین متغیر ژن و متغیرهای سن، قد و وزن نیز همبستگی وجود ندارد که این نتایج همراستا با برخی از مطالعات یادشده نیز میباشد.
نتیجهگیری
نتایج مطالعه انجامشده میزان جهش هموزیگوت منطقه گناباد در جامعه مورد مطالعه را بالاتر از مطالعات مشابه نشان میدهد و انجام مطالعات همهگیرشناسی و مولکولی بیشتر، برای نتیجهگیری بهتر مورد نیاز است. باتوجهبه نتایج مطالعه حاضر اهمیت این جهش در گیرنده CCR5 در اهداکنندگانی خونی است که از این نظر هموزیگوت بودند و این افراد میتوانند بهعنوان نامزدهای شرکت در آزمایشهای مبتنی بر سلولهای بنیادی برای ایجاد یک پنجره درمانی یا حتی بهعنوان یک روش برای جلوگیری از ابتلا افراد به HIV باشند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه مصوب کمیته اخلاق در پژوهشهای زیست پزشکی دانشگاه علوم پزشکی گناباد است و با کد IR.GMU. REC.1398.119 ثبت شده است.
حامی مالی
این مطالعه با حمایت مالی معاونت تحقیقات و فناوری ( با کد طرح: 1-1845-10 / A) دانشگاه علوم پزشکی گناباد انجام شده است.
مشارکت نویسندگان
ایده اصلی، طراحی مطالعه، گردآوری اطلاعات و انجام آزمایشات تخصصی: جعفر حاجوی؛ مرور نقادانه دستنویس و مرور نهایی: جعفر حاجوی، حسین نظامی و فائزه طهرانیان؛ تحلیل داده: حسین نظامی؛ جمعآوری داده: محمدحسین جعفرزاده مایوان، جواد اکبرزاده ثانی و فائزه طهرانیان؛ گردآوری اطلاعات و طراحی مطالعه: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان و مجریان طرح از تمام عزیزانی که در انجام این طرح، همکاریهای و مهربونی خود را از ما دریغ نکردند، تشکر میکنند. همچنین از معاونت تحقیقات و فناوری دانشگاه علوم پزشکی گناباد به موجب حمایت مالی و معنوی در انجام این طرح تقدیر و تشکر میشود.
کموکاینها در توسعه و هموستاز سیستم ایمنی بدن بهدلیل توانایی خود در تحریک مهاجرت سلولها بهویژه لکوسیتها، نقش مهمی ایفا میکنند و در همه واکنشهای محافظتی یا مخرب ایمنی و التهابی نقش دارند. بااینحال، مهاجرت گلبولهای سفید تحت هدایت کموکاین همچنین به بیماریهایی که دارای اجزای ایمنی یا التهابی هستند مانند خودایمنی، آلرژی، بیماریهای التهابی مزمن، سرطان و بسیاری دیگر کمک میکنند [1].
گیرنده CCR5 یک گیرنده شیمیایی هپتامر از خانواده G-coupled پروتئینها است. این گیرنده در شرایط التهابی ایجاد میشود و نقش مهمی در جذب لکوسیتهای دخالتکننده در سیستم دفاعی بدن دارد [2].
آلودگی به ویروس HIV بهعنوان یک معضل اجتماعی مهم، سلامت جامعه را به خطر میاندازد. با وجود تلاشها و برنامهریزیهای گسترده سازمان بهداشت جهانی، انتشار بالای بیماری HIV همواره سبب ایجاد زیانهای اقتصادی، اجتماعی و بهداشتی شده است [3].
ویروس HIV برای ورود به سلول از گیرندههای شیمیایی مختلفی از جمله CCR5 و CXCR4 استفاده میکند [3]، CCR5 مهمترین گیرنده مشترک در مراحل اولیه عفونت است و بیشتر افراد آلوده به این ویروس تنها از این طریق مبتلا شدهاند [4, 5]. همچنین انتقال این ویروس از فردی به فرد دیگر تقریباً بهصورت انحصاری به این گیرنده محدود میشود [3].
مطالعات ژنتیکی نشان میدهد این ژن حاوی 4 اگزون بر روی کروموزوم شماره 3 است [6]، اما فقط اگزون 4 قابلیت بیان شدن دارد. برخی افراد بهطور ارثی دارای یک جهش 32 جفت بازی (∆32) در اگزون ژن این گیرنده میباشند [3]. افراد دارای جهش 23∆، مولکول CCR5 را بر سطح سلولهای خود بیان نمیکنند و یا فرم غیر عملکردی و ناقص این مولکول را بیان میکنند، بنابراین باتوجهبه اهمیت گیرنده CCR5 در ایجاد کموتاکسی مناسب سلولهای ایمنی و همچنین نقش آن در آلودگی لنفوسیتهای T و ماکروفاژها به HIV، جهش32∆ در ژن این مولکول میتواند با تغییر عملکرد در سلولهای ایمنی و همچنین مقاومت نسبی به HIV همراه باشد [7]. فراوانی این جهش در مناطق جغرافیایی و قومیتهای مختلف متفاوت است [6]. ازاینرو بررسی این مولکول ازنظر همهگیرشناسی نیز حائز اهمیت است. بسته به عوامل خاص مانند الگوی بیماری، جغرافیای نمونهها و گروه خونی مورد مطالعه نقش CCR5 در بیماری، متفاوت است [8].
باتوجهبه تحقیقات انجامشده کمبود CCR5 در افراد بهعلت جبران توسط سایر گیرندههای شیمیایی و لیگاندهای آنها احساس نمیشود و افراد میتوانند بهطور نرمال رشد کنند [9]. زمانی که فردی در جهش CCR5-∆32 هموزیگوس باشد، بهعلت اینکه هیچ رسپتوری در سطح سلولها بیان نمیشود، نسبت به HIVمقاوم و زمانی که هتروزیگوس باشد، تعداد کمی رسپتور در سطح سلول بیان میشود که سبب کاهش پیشرفت بیماری [10] یا حتی تأخیر در ابتلا فرد بهHIV میشود [11].
برنامههای کاربردی موفق از مدلهای مبتنی بر لیگاند و بینشهای اخیر در مورد مکانیسم HIV یک استراتژی جدید را با هدف جلوگیری از چسبندگی و گسترش ویروسی آغاز کرده است. یک رویکرد امیدوارکننده، مبتنی بر بهکارگیری عواملی است که قادر به متوقف کردن تعامل پروتئینهای ویروسی با گیرنده غشای سلولی میزبان CD4 و گیرندههای CCR5 و CXCR4 هستند. همچنین گیرنده CCR5 ممکن است درزمینه توسعه بسیاری از بیماریهای دیگر چون سرطانها و هپاتیت و آنفولانزا و بیماریهای خودایمنی مانند مالتیپل اسکلروزیس و آرتریت روماتوئید مؤثر باشد [3, 8, 12-14].
باتوجهبه اهمیت جهش دلتا 32 در ایجاد مقاومت نسبت به بیماریهای مختلف بهویژه عفونت ویروس HIV، ما نیز بر آن شدیم تا در این پژوهش به بررسی میزان شیوع این جهش در افراد مراجعهکننده به مرکز بهداشت گناباد باتوجهبه شرایط موجود بپردازیم.
مواد و روشها
در این مطالعه توصیفیمقطعی، جامعه مورد مطالعه افراد سالم شهر گناباد بودند که با دارا بودن معیارهای ورود شامل سن بالای 18سال و عدم ابتلا به بیماریهایی همانند دیابت، هپاتیت، بیماریهای خود ایمنی و غیره طبق اظهارنظر فرد، وارد مطاالعه شدند. با استفاده از روش نمونهگیری مبتنی بر هدف، 293 نفر وارد مطالعه شدند. نمونهگیری با هماهنگی معاونت بهداشت دانشگاه از مراجعین به مرکز بهداشت بعد از توضیح کامل طرح و اهمیت موضوع و دریافت رضایتنامه کتبی و پس از ورود به مطالعه انجام میشود و پس از انجام تست سریع (کیت ABON)، براساس تکنولوژی ایمونوکروماتوگرافی عمل میکند، مقدار 5 سیسی خون وریدی در نمونههای حای ضدانعقاد EDTA از افراد گرفته شد و نمونهها در شرایط سرد به آزمایشگاه ایمونولوژی دانشکده پیراپزشکی منتقل و استخراج DNA با روش ستونی(کیت شرکت کارمانیا پارس ژن) و استریل انجام شد. سپس جهش با روش مولکولی PCR با استفاده از کیت شرکت کارمانیا پارس ژن، بررسی شد و نتایج پس از ران کردن محصول PCR مربوط به نمونهها بر روی ژل آگارز 3 درصد و مشاهده وجود یا عدم وجود باند مربوطه به DNA تحلیل شد.
روش تجزیهوتحلیل آماری
دادههای گردآوریشده وارد نرمافزار SPSS نسخه 22 شدند و پس از اطمینان از صحت ورود دادهها، دادههای متغیرهای کیفی با جداول توزیع فراوانی( تعداد و درصد)و دادههای کمی با میانگین و انحرافمعیار توصیف شدند. برای مقایسه فراوانی مشاهدات در سطوح متغیرهای کیفی از آزمون کایاسکوئر استفاده شد. در این مطالعه سطح معنادار 0/05 استفاده شده است.
یافته ها
مطالعه حاضر به جهت بررسی فراوانی جهش دلتا32 (23∆) مربوط به گیرنده کموکاینی CCR5در مراجعین به مرکز بهداشت شهرستان گناباد و ارتباط آن با خصوصیات جمعیتشناختی و برخی از بیماریها در سالهای 1397 تا 1398 انجام شده است. در این مطالعه دادههای 293 فرد تجزیهوتحلیل شد. میانگین سنی افراد تحت مطالعه 10/84±53/22 سال بود. 65 نفر زن (23/2 درصد) و 225 نفر مرد (8/ درصد 76) بودند. 293 افراد مراجعهکننده به مرکز بهداشت ژن بهترتیب 269 نفر (91/8 درصد) 3 حالت سالم (188bp)، 15 نفر (5/1 درصد) هتروزیگوت (188bp و 156bp) و 9 نفر (3/1) هموزیگوت (156bp) بودند (جدول شماره 1).

باتوجهبه جدول شماره 2، نتایج آزمون کایاسکوئر نشان داد هیچ ارتباط معناداری بین متغیر ژن با متغیرهای جمعیتشناختی ( سیگاری بودن، مصرف مشروبات الکی، جنسیت و بیماریها (دیابت، سرطان و هپاتیت) وجود ندارد.

بحث
طبق آمارهای سازمان بهداشت جهانی در پایان سال 2018 حدود 9/37 میلیون نفر مبتلا به ویروس HIV در کل جهان گزارش شده است. در واقع، ایرانیان بهعنوان یک جمعیت قفقازی بسیار مختلط در نظر گرفته میشوند که دلایل متعددی ممکن است دلیل تنوع ژنتیکی گسترده آنها باشد [12]. از طرف دیگر باتوجهبه مطالعات قبلی در ایران، شرایط جغرافیایی و قومیتهای مختلف، جهش دلتا32 از شیوع متفاوتی برخوردار میباشد.
باتوجهبه اهمیت این گیرنده در درمان و پیشگیری HIV، مطالعه حاضر با هدف بررسی فراوانی جهش دلتا32 (32∆) مربوط به گیرنده کموکاینی CCR5 در مراجعین به مرکز بهداشت شهرستان گناباد در سالهای 1397و 1398 انجام شد.
نتایج نشان داد از293 افراد مراجعهکننده به مرکز بهداشت، بهترتیب 269 نفر (91/8 درصد) ژن سالم و بدون جهش(188bp)، 15 نفر (5/1 درصد) جهش هتروزیگوت (188bp و 156bp) و 9 نفر (3/1) جهش هموزیگوت بر روی هر دو آلل CCR5(156bp)را دارا بودند.
برخلاف مطالعه حاضر، مطالعه فرشباف و همکاران در 200 فرد سالم در زنجان نشان داد فقط 1 نفر (0/5 درصد)، ازنظر این جهش هموزیگوت میباشند [13]. در مطالعه حاضر افراد هتروزیگوت 5/1 درصد بودند، درحالیکه در مطالعه عمرانی در 190 فرد سالم در ارومیه نشان داد که فراوانی جهش دلتا 32 هتروزیگوت 2/1 درصد میباشد [14].
برخلاف این مطالعه جهش هتروزیگوت دلتا32 در شمال اروپا مربوط به جمعیت قفقازی با 16 درصد (هتروزیگوت) و 1 درصد(هموزیگوت) میباشد و در کشورهای فنلاند، سوئد ایسلند و شمال روسیه 15 تا 16 درصد میباشد [15، 16]. این فراوانی در کشورهای مرکز و غرب اروپا به 10 درصد و در جنوب اروپا (یونان و پرتقال) به 4تا 6 درصد، کاهش مییابد [15، 17]. جهش هتروزیگوت در جنوب اروپا تقریباً مشابه با مطالعه حاضر (5/1 درصد) میباشد.
مطالعه انجامشده در روسیه در 300 فرد سالم نشان داد که ازنظر جهش دلتا 32، 79 نفر (18/33 درصد) هتروزیگوت و 7 نفر (1/67 درصد) هموزیگوت بودند [18] که جهش هتروزیگوت نسبت به مطالعه حاضر 3 برابر بود، اما مطالعه هموزیگوت کمتر از مطالعه ما بود.
مطالعه قرهگوزلو و همکاران در 395 فرد سالم در استان فارس نشان داد که افراد ازنظر جهش دلتا32، 97/2 درصد سالم، 2/8 درصد هتروزیگوت میباشند و هیچ فرد هموزیگوت شناسایی نشد [12].
در مطالعه گواروسکایا و همکاران با هدف بررسی فراوانی جهش CCR5-∆32 در جمعیت روس، تاتار و باشکیرهای استان چلبابینسک، 7 نفر هموزیگوس و 79 نفر هتروزیگوس شناسایی شدند [18]. بادی و همکاران در مطالعه مقطعی از بین 200 نفر مبتلا به HIV که به بیمارستان امام خمینی تهران مراجعه کرده بودند و بیماری آنها تأیید شده بود، بهطور تصادفی 194 بیمار وارد مطالعه شدند که از این تعداد فقط 8 نفر از نظر CCR5-∆32 هتروزیگوت بودند و هیچ هموزیگوت شناسایی نشد [19]. برخلاف مطالعه حاضر در مطالعه مقطعی در امارات و تونس که الجابری و همکاران انجام دادند، نشان داده شد این جهش بسیار نادر بوده است، بهطوریکه هیچ هموزیگوت در جمعیت مورد مطالعه یافت نشد و در بین افراد اماراتی تنها 1 نفر و در تونسیها نیز 4 هتروزیگوت بودهاند [6]. مطالعه فراتحلیلی که در دانمارک پراهالاد منتشر کرده است، اذعان کرد که این نتایج بهشدت نشاندهنده این است که آلل CCR5-∆32 سبب حفاظت افرادی با نژاد اروپایی در مقابل این بیماری میشود و افراد هموزیگوت در این جهش تأثیر محافظتی بیشتری را نسبت به هتروزیگوت نشان میدهند [20]. همانطورکه در مطالعات پیشگفت نشان میدهد شیوع این جهش در مناطق جغرافیایی و قومیتهای مختلف میتواند متفاوت باشد.
برخلاف مطالعه حاضر، رویز-ماتئوس و همکاران در مطالعه خود به تأیید و گسترش نقش CCR5-∆32 بهعنوان عامل پیشبینیکننده برای بقا در عفونت HIV و همچنین افزایش طول مدت بقا در افرادی که درمان ترکیبی ضدرترو ویروسی را دریافت کردهاند، میپردازد، اما در این مطالعه هیچ جهش هموزیگوت یافت نشد [21].
نتایج مطالعه مقطعی که حیدریفرد و همکارن انجام دادند، نشان میدهد جهش دلتا32 در افراد هتروریگوت حساسیت آنها به عفونت HIV را تحت تأثیر قرار نمیدهد [22].
در مطالعه مروری زارعبیدکی و همکاران نشان داده شد براساس دادههای موجود احتمال دارد جهش CCR5-∆32 در جمعیت عادی ایرانیها شایع نباشد [23].
باتوجهبه نتایج مطالعات یادشده و مطالعه حاضر، از جهت مؤثر بودن جهش CCR5-∆32 در برابر بیماریهای مختلف بهویژه HIV همراستا نبوده است و احتمالاً میتواند بهعلت متفاوت بودن مناطق جغرافیایی و یا قومیت مختلف آنها و یا حتی تفاوت در تعداد نمونه مطالعات باشد.
نتایج بهدستآمده از مطالعه حاضر هیچ ارتباط معناداری بین متغیر ژن با متغیرهای جمعیتشناختی (سیگاری بودن، مصرف مشروبات الکی، جنسیت و بیماریها (دیابت، سرطان و هپاتیت) را نشان نمیدهد. همچنین بین متغیر ژن و متغیرهای سن، قد و وزن نیز همبستگی وجود ندارد که این نتایج همراستا با برخی از مطالعات یادشده نیز میباشد.
نتیجهگیری
نتایج مطالعه انجامشده میزان جهش هموزیگوت منطقه گناباد در جامعه مورد مطالعه را بالاتر از مطالعات مشابه نشان میدهد و انجام مطالعات همهگیرشناسی و مولکولی بیشتر، برای نتیجهگیری بهتر مورد نیاز است. باتوجهبه نتایج مطالعه حاضر اهمیت این جهش در گیرنده CCR5 در اهداکنندگانی خونی است که از این نظر هموزیگوت بودند و این افراد میتوانند بهعنوان نامزدهای شرکت در آزمایشهای مبتنی بر سلولهای بنیادی برای ایجاد یک پنجره درمانی یا حتی بهعنوان یک روش برای جلوگیری از ابتلا افراد به HIV باشند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه مصوب کمیته اخلاق در پژوهشهای زیست پزشکی دانشگاه علوم پزشکی گناباد است و با کد IR.GMU. REC.1398.119 ثبت شده است.
حامی مالی
این مطالعه با حمایت مالی معاونت تحقیقات و فناوری ( با کد طرح: 1-1845-10 / A) دانشگاه علوم پزشکی گناباد انجام شده است.
مشارکت نویسندگان
ایده اصلی، طراحی مطالعه، گردآوری اطلاعات و انجام آزمایشات تخصصی: جعفر حاجوی؛ مرور نقادانه دستنویس و مرور نهایی: جعفر حاجوی، حسین نظامی و فائزه طهرانیان؛ تحلیل داده: حسین نظامی؛ جمعآوری داده: محمدحسین جعفرزاده مایوان، جواد اکبرزاده ثانی و فائزه طهرانیان؛ گردآوری اطلاعات و طراحی مطالعه: همه نویسندگان.
تعارض منافع
بنابر اظهار نویسندگان، این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان و مجریان طرح از تمام عزیزانی که در انجام این طرح، همکاریهای و مهربونی خود را از ما دریغ نکردند، تشکر میکنند. همچنین از معاونت تحقیقات و فناوری دانشگاه علوم پزشکی گناباد به موجب حمایت مالی و معنوی در انجام این طرح تقدیر و تشکر میشود.
References
1.Hughes CE, Nibbs RJB. A guide to chemokines and their receptors. The FEBS Journal. 2018; 285(16): 2944-71. [DOI: 10. 1111/febs. 14466] [PMID] [PMCID]
2.Upadhyaya C, Jiao X, Ashton A, Patel K, Kossenkov AV, Pestell RG. The G protein coupled receptor CCR5 in cancer. Advances in Cancer Research. 2020; 145: 29-47. [DOI: 10. 1016/bs. acr. 2019. 11. 001] [PMID] [PMCID]
3.Vangelista L, Vento S. The expanding therapeutic perspective of CCR5 blockade. Frontiers in Immunology. 2017; 8: 1981. [DOI: 10. 3389/fimmu. 2017. 01981] [PMID] [PMCID]
4.Venuti A, Pastori C, Lopalco L. The role of natural antibodies to CC chemokine receptor 5 in HIV infection. Frontiers in Immunology. 2017; 8: 1358. [DOI: 10. 3389/fimmu. 2017. 01358] [PMID] [PMCID]
5.Zhang Y, Chen HF. Allosteric mechanism of an oximino-piperidino-piperidine antagonist for the CCR5 chemokine receptor. Chemical Biology & Drug Design. 2020; 95(1): 113-23. [DOI: 10. 1111/cbdd. 13627] [PMID]
6.Al-Jaberi SA, Ben-Salem S, Messedi M, Ayadi F, Al-Gazali L, Ali BR. Determination of the CCR5∆32 frequency in Emiratis and Tunisians and the screening of the CCR5 gene for novel alleles in Emiratis. Gene. 2013; 529(1): 113-8. [DOI: 10. 1016/j. gene. 2013. 07. 062] [PMID]
7.Youssef AI, Hassan AA, Mohammed SA, Ahmed HA. Distribution of the chemokine receptor-5 gene in Egyptian breast cancer patients. Benha Medical Journal. 2018; 35(1): 49. [Link]
8.Rautenbach A, Williams AA. Metabolomics as an approach to characterise the contrasting roles of CCR5 in the presence and absence of disease. International Journal of Molecular Sciences. 2020; 21(4): 1472. [DOI: 10. 3390/ijms21041472] [PMID] [PMCID]
9.Scurci I, Martins E, Hartley O. CCR5: Established paradigms and new frontiers for a ‘celebrity’ chemokine receptor. Cytokine. 2018; 109: 81-93. [DOI: 10. 1016/j. cyto. 2018. 02. 018] [PMID]
10.Atzeni F, Boiardi L, Casali B, Farnetti E, Nicoli D, Sarzi-Puttini P, et al. CC chemokine receptor 5 polymorphism in Italian patients with Behcet’s disease. Rheumatology (Oxford, England). 2012; 51(12): 2141-5. [DOI: 10. 1093/rheumatology/kes238] [PMID]
11.Juhász E, Béres J, Kanizsai S, Nagy K. The consequence of a founder effect: CCR5-32, CCR2-64I and SDF1-3’A polymorphism in vlach gypsy population in Hungary. Pathology Oncology Research: POR. 2012; 18(2): 177-82. [DOI: 10. 1007/s12253-011-9425-4] [PMID]
12.Gharagozloo M, Doroudchi M, Farjadian S, Pezeshki AM, Ghaderi A. The frequency of CCR5Δ32 and CCR2-64I in southern Iranian normal population. Immunology Letters. 2005; 96(2): 277-81. [DOI: 10. 1016/j. imlet. 2004. 09. 007] [PMID]
13.Farshbaf A, Biglari A, Faghihzadeh S, Esmaeilzadeh A. [Frequency of CCR5Δ32 allelic mutation in healthy individuals in Zanjan province (Persian)]. Journal of Advances in Medical and Biomedical Research. 2017; 25(108): 129-36. [Link]
14.Omrani D. Frequency of CCR5Δ 32 variant in north-west of Iran. Journal of Sciences, Islamic Republic of Iran. 2009; 20(2): 105-10. [Link]
15.Martinson JJ, Chapman NH, Rees DC, Liu YT, Clegg JB. Global distribution of the CCR5 gene 32-basepair deletion. Nature Genetics. 1997; 16(1): 100-3. [DOI: 10. 1038/ng0597-100] [PMID]
16.Libert F, Cochaux P, Beckman G, Samson M, Aksenova M, Cao A, et al. he deltaccr5 mutation conferring protection against HIV-1 in Caucasian populations has a single and recent origin in Northeastern Europe. Human Molecular Genetics. 1998; 7(3): 399-406. [DOI: 10. 1093/hmg/7. 3. 399] [PMID]
17.Papa A, Papadimitriou E, Adwan G, Clewley JP, Malissiovas N, Ntoutsos I, et al. HIV-1 co-receptor CCR5 and CCR2 mutations among Greeks. FEMS Immunology & Medical Microbiology. 2000; 28(1): 87-9. [DOI: 10. 1111/j. 1574-695X. 2000. tb01461. x] [PMID]
18.Govorovskaya I, Khromova E, Suslova T, Alexeev L, Kofiadi I. The Frequency of CCR5del32 mutation in populations of Russians, Tatars and Bashkirs of Chelyabinsk Region, Russia. Archivum Immunologiae et Therapiae Experimentalis. 2016; 64(Suppl 1): 109-12. [DOI: 10. 1007/s00005-016-0429-3] [PMID]
19.Badie BM, Najmabadi H, Djavid GE, Kheirandish P, Payvar F, Akhlaghkhah M, et al. Frequency of CCR5 delta 32 polymorphism and its relation to disease progression in Iranian HIV-1 positive individuals: P1200. Clinical Microbiology & Infection. 2010; 16. [DOI:10.15406/jhvrv.2015.02.00059]
20.Prahalad S. Negative association between the chemokine receptor CCR5-Delta32 polymorphism and rheumatoid arthritis: A meta-analysis. Genes and Immunity. 2006; 7(3): 264-8. [DOI:10. 1038/sj. gene. 6364298] [PMID] [PMCID]
21.Ruiz-Mateos E, Tarancon-Diez L, Alvarez-Rios AI, Dominguez-Molina B, Genebat M, Pulido I, et al. Association of heterozygous CCR5Δ32 deletion with survival in HIV-infection: A cohort study. Antiviral Research. 2018; 150: 15-9. [DOI: 10. 1016/j. antiviral. 2017. 12. 002] [PMID]
22.Heydarifard Z, Tabarraei A, Moradi A. Polymorphisms in CCR5Δ32 and Risk of HIV-1 Infection in the Southeast of Caspian Sea, Iran. Disease Markers. 2017; 2017: 4190107. [DOI: 10. 1155/2017/4190107] [PMID] [PMCID]
23.Zare-Bidaki M, Karimi-Googheri M, Hassanshahi G, Zainodini N, Arababadi MK. The frequency of CCR5 promoter polymorphisms and CCR5 Δ 32 mutation in Iranian populations. Iranian Journal of Basic Medical Sciences. 2015; 18(4): 312-6. [PMID]
نوع مطالعه: پژوهشی |
موضوع مقاله:
علوم پايه پزشكي
دریافت: 1401/6/21 | پذیرش: 1401/9/2 | انتشار: 1401/7/1
دریافت: 1401/6/21 | پذیرش: 1401/9/2 | انتشار: 1401/7/1
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





